Bài 38: Hệ thống hóa về hiđrocacbon
1. CTPT và đặc điểm cấu tạo của hidrocacbon
.png)
2. TÍNH CHẤT HÓA HỌC CỦA HIDROCACBON
.png)
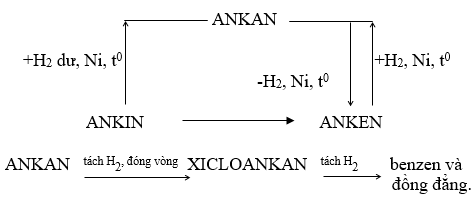
3. SỰ CHUYỂN HÓA GIỮA CÁC LOẠI HIDROCACBON
Hình: Sơ đồ chuyển hóa giữa các loại hidrocacbon
Bài 1:
Crackinh hoàn toàn V lít ankan X thu được hỗn hợp Y gồm 0,1V lít C3H8; 0,6V lít CH4; 1,8V lít các hidrocacbon khác. Tỉ khối của Y so với H2 là 14,4. Dẫn 1 mol Y đi qua bình chứa dung dịch Brom dư, phản ứng kết thúc thấy khối lượng bình tăng m gam. Biết các thể tích khí đo ở cùng điều kiện, chỉ có ankan tham gia phản ứng crackinh. Giá trị của m là:
Hướng dẫn:
Do tỉ lệ mol cũng bằng tỉ lệ thể tích ở cùng điều kiện nên nếu xét 1 mol Y
\(\Rightarrow n_Y = n_{C_3H_8} + n_{CH_4} + n_{HC khac} = 0,1n_X + 0,6n_X + 1,8n_X\)
⇒ nX = 0,4 mol
Bảo toàn khối lượng: mX = mY = 2 × 14,4 × 1 = 28,8 g
⇒ MX = 72 g ⇒ X là C5H12
Các phản ứng cracking xảy ra:
+/ C5H12 → CH4 + C4H8
+/ C5H12 → C3H8 + C2H4
+/ C5H12 → C2H6 + C3H6
+/ C3H8 → CH4 + C2H4 (*) ⇒ C5H12 → CH4 + 2C2H4
⇒ ở PT (*) có: \(n_{C_2H_4} = 2(n_Y - 2n_X )= 0,4\ mol\)
\(\Rightarrow n_{C_4H_8} = 0,04\ mol;\ n_{C_3H_8} = 0,04\ mol\)
\(\Rightarrow n_{C_2H_4} = 0,44\ mol \Rightarrow n_{HC\ khac} = n_{C_4H_8} + n_{C_2H_4} + n_{C_2H_6} + n_{C_3H_6}\)
\(\Rightarrow n_{C_2H_6} = n_{C_3H_6} = 0,12\ mol\)
⇒ Brom phản ứng được với C4H8; C3H6; C2H4.
⇒ mtăng \(= m_{C_4H_8} + m_{C_2H_4} + m_{C_3H_6} = 19,6\ g\)
Bài 2:
Cho hỗn hợp hai anken đồng đẳng kế tiếp nhau tác dụng với nước (có H2SO4 làm xúc tác) thu được hỗn hợp Z gồm hai rượu (ancol) X và Y. Đốt cháy hoàn toàn 1,06 gam hỗn hợp Z sau đó hấp thụ toàn bộ sản phẩm cháy vào 2 lít dung dịch NaOH 0,1M thu được dung dịch T trong đó nồng độ của NaOH bằng 0,05M. Công thức cấu tạo thu gọn của X và Y là (Cho: H = 1; C = 12; O = 16; thể tích dung dịch thay đổi không đáng kể)
Hướng dẫn:
Gọi CTPT trung bình 2 anken là \(C_{\bar{n}} H_{2\bar{n}}\)
(\(\Rightarrow\) ancol tương ứng \(C_{\bar{n}} H_{2\bar{n} +2}O\))
+ Đốt cháy:
\(C_{\bar{n}} H_{2\bar{n}+2}O\ +\frac{3\bar{n}}{2}O_2\rightarrow \bar{n}CO_2+(\bar{n}+1)H_2O\)
+ Do sản phẩm cháy đi vào NaOH sau đó còn dư bazo nên CO2 tạo muối Na2CO3:
2NaOH + CO2 → Na2CO3 + H2O
\(\Rightarrow 0,5\times n_{NaOH \ pu} = n_{CO2} = 0,5\times 2\times (0,1 - 0,05) = 0,05\) (mol)
\(\Rightarrow C_{\bar{n}} H_{2\bar{n}+2}O=\frac{0,05}{\bar{n}}\) (mol)
\(\Rightarrow M_{C_{\bar{n}} H_{2\bar{n} +2}O}=14\bar{n}+18=\frac{1,06}{\frac{0,05}{\bar{n}}}\Rightarrow \bar{n}=2,5\)
\(\Rightarrow\) Mà 2 anken là đồng đẳng liên tiếp
\(\Rightarrow\) chúng là C2H5OH và C3H7OH
Bài 3:
Hấp thụ vừa đủ hỗn hợp khí X gồm etilen và propilen vào dung dịch KMnO4 31,6% ở nhiệt độ thấp thu được dung dịch Y chỉ chứa 3 chất tan là etilenglicol, propan-1-2-điol, kali hidroxit và kết tủa Z. Trong dung dịch Y nồng độ % của etilenglicol là 6,906%. Phần trăm hối lượng prpilen trong X là:
Hướng dẫn:
Gọi khối lượng anken hấp thụ là m g có x mol etilen và y mol propen.
⇒ m = 28x + 42y
Giả sử có 100g dung dịch thuốc tím ⇒ n\(\tiny KMnO_4\) = 0,2 mol
Các quá trình:
+ Cho e: anken → diol + 2e
+ Nhận e: MnO4- + 2H2O + 3e → MnO2 + 4OH-
⇒ n e trao đổi = 2x + 2y = 0,2 × 3 = 0,6 mol (1)
⇒ m rắn không tan = 17,4 g
⇒ m dd sau = m dd thuốc tím + m anken – m rắn = 82,6 + m
⇒ C% etilenglicol = \(\frac{62x}{82,6 +28x + 42y}\) = 0,06906 (2)
Từ 1 và 2 ⇒ x = 0,104 mol; y= 0,196 mol
%m propilen (X) = 73,75%
Bài 4:
Đốt cháy hoàn toàn 4,64 gam một hiđrocacbon X (chất khí ở điều kiện thường) rồi đem toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2. Sau các phản ứng thu được 39,4 gam kết tủa và khối lượng phần dung dịch giảm bớt 19,912 gam. Công thức phân tử của X là:
Hướng dẫn:
\(m_{\downarrow} = 39,4 \ gam\)
Khối lượng dung dịch giảm bớt 19,912 gam
\(\begin{array}{l}
\Rightarrow {m_ \downarrow } - ({m_{C{O_2}}} + {m_{{H_2}O}}) = 19,912\\
\Rightarrow {m_{C{O_2}}} + {m_{{H_2}O}} = 19,488\\
{m_C} + {m_H} = {m_{hh}} = 4,64\\
X:{C_x}{H_y}\left\{ {\begin{array}{*{20}{c}}
{12x + y = 4,64\;\;\;\;\;\;\;}\\
{44x + 18.\frac{y}{2} = 19,488}
\end{array}} \right.\\
\Rightarrow \left\{ {\begin{array}{*{20}{c}}
{x = 0,348}\\
{y = 0,464}
\end{array}} \right.\\
x:y = 0,348:0,464 = 3:4\\
\Rightarrow {C_3}{H_4}
\end{array}\)
1. CTPT và đặc điểm cấu tạo của hidrocacbon
.png)
2. TÍNH CHẤT HÓA HỌC CỦA HIDROCACBON
.png)
3. SỰ CHUYỂN HÓA GIỮA CÁC LOẠI HIDROCACBON
Hình: Sơ đồ chuyển hóa giữa các loại hidrocacbon
Bài 1:
Crackinh hoàn toàn V lít ankan X thu được hỗn hợp Y gồm 0,1V lít C3H8; 0,6V lít CH4; 1,8V lít các hidrocacbon khác. Tỉ khối của Y so với H2 là 14,4. Dẫn 1 mol Y đi qua bình chứa dung dịch Brom dư, phản ứng kết thúc thấy khối lượng bình tăng m gam. Biết các thể tích khí đo ở cùng điều kiện, chỉ có ankan tham gia phản ứng crackinh. Giá trị của m là:
Hướng dẫn:
Do tỉ lệ mol cũng bằng tỉ lệ thể tích ở cùng điều kiện nên nếu xét 1 mol Y
\(\Rightarrow n_Y = n_{C_3H_8} + n_{CH_4} + n_{HC khac} = 0,1n_X + 0,6n_X + 1,8n_X\)
⇒ nX = 0,4 mol
Bảo toàn khối lượng: mX = mY = 2 × 14,4 × 1 = 28,8 g
⇒ MX = 72 g ⇒ X là C5H12
Các phản ứng cracking xảy ra:
+/ C5H12 → CH4 + C4H8
+/ C5H12 → C3H8 + C2H4
+/ C5H12 → C2H6 + C3H6
+/ C3H8 → CH4 + C2H4 (*) ⇒ C5H12 → CH4 + 2C2H4
⇒ ở PT (*) có: \(n_{C_2H_4} = 2(n_Y - 2n_X )= 0,4\ mol\)
\(\Rightarrow n_{C_4H_8} = 0,04\ mol;\ n_{C_3H_8} = 0,04\ mol\)
\(\Rightarrow n_{C_2H_4} = 0,44\ mol \Rightarrow n_{HC\ khac} = n_{C_4H_8} + n_{C_2H_4} + n_{C_2H_6} + n_{C_3H_6}\)
\(\Rightarrow n_{C_2H_6} = n_{C_3H_6} = 0,12\ mol\)
⇒ Brom phản ứng được với C4H8; C3H6; C2H4.
⇒ mtăng \(= m_{C_4H_8} + m_{C_2H_4} + m_{C_3H_6} = 19,6\ g\)
Bài 2:
Cho hỗn hợp hai anken đồng đẳng kế tiếp nhau tác dụng với nước (có H2SO4 làm xúc tác) thu được hỗn hợp Z gồm hai rượu (ancol) X và Y. Đốt cháy hoàn toàn 1,06 gam hỗn hợp Z sau đó hấp thụ toàn bộ sản phẩm cháy vào 2 lít dung dịch NaOH 0,1M thu được dung dịch T trong đó nồng độ của NaOH bằng 0,05M. Công thức cấu tạo thu gọn của X và Y là (Cho: H = 1; C = 12; O = 16; thể tích dung dịch thay đổi không đáng kể)
Hướng dẫn:
Gọi CTPT trung bình 2 anken là \(C_{\bar{n}} H_{2\bar{n}}\)
(\(\Rightarrow\) ancol tương ứng \(C_{\bar{n}} H_{2\bar{n} +2}O\))
+ Đốt cháy:
\(C_{\bar{n}} H_{2\bar{n}+2}O\ +\frac{3\bar{n}}{2}O_2\rightarrow \bar{n}CO_2+(\bar{n}+1)H_2O\)
+ Do sản phẩm cháy đi vào NaOH sau đó còn dư bazo nên CO2 tạo muối Na2CO3:
2NaOH + CO2 → Na2CO3 + H2O
\(\Rightarrow 0,5\times n_{NaOH \ pu} = n_{CO2} = 0,5\times 2\times (0,1 - 0,05) = 0,05\) (mol)
\(\Rightarrow C_{\bar{n}} H_{2\bar{n}+2}O=\frac{0,05}{\bar{n}}\) (mol)
\(\Rightarrow M_{C_{\bar{n}} H_{2\bar{n} +2}O}=14\bar{n}+18=\frac{1,06}{\frac{0,05}{\bar{n}}}\Rightarrow \bar{n}=2,5\)
\(\Rightarrow\) Mà 2 anken là đồng đẳng liên tiếp
\(\Rightarrow\) chúng là C2H5OH và C3H7OH
Bài 3:
Hấp thụ vừa đủ hỗn hợp khí X gồm etilen và propilen vào dung dịch KMnO4 31,6% ở nhiệt độ thấp thu được dung dịch Y chỉ chứa 3 chất tan là etilenglicol, propan-1-2-điol, kali hidroxit và kết tủa Z. Trong dung dịch Y nồng độ % của etilenglicol là 6,906%. Phần trăm hối lượng prpilen trong X là:
Hướng dẫn:
Gọi khối lượng anken hấp thụ là m g có x mol etilen và y mol propen.
⇒ m = 28x + 42y
Giả sử có 100g dung dịch thuốc tím ⇒ n\(\tiny KMnO_4\) = 0,2 mol
Các quá trình:
+ Cho e: anken → diol + 2e
+ Nhận e: MnO4- + 2H2O + 3e → MnO2 + 4OH-
⇒ n e trao đổi = 2x + 2y = 0,2 × 3 = 0,6 mol (1)
⇒ m rắn không tan = 17,4 g
⇒ m dd sau = m dd thuốc tím + m anken – m rắn = 82,6 + m
⇒ C% etilenglicol = \(\frac{62x}{82,6 +28x + 42y}\) = 0,06906 (2)
Từ 1 và 2 ⇒ x = 0,104 mol; y= 0,196 mol
%m propilen (X) = 73,75%
Bài 4:
Đốt cháy hoàn toàn 4,64 gam một hiđrocacbon X (chất khí ở điều kiện thường) rồi đem toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2. Sau các phản ứng thu được 39,4 gam kết tủa và khối lượng phần dung dịch giảm bớt 19,912 gam. Công thức phân tử của X là:
Hướng dẫn:
\(m_{\downarrow} = 39,4 \ gam\)
Khối lượng dung dịch giảm bớt 19,912 gam
\(\begin{array}{l}
\Rightarrow {m_ \downarrow } - ({m_{C{O_2}}} + {m_{{H_2}O}}) = 19,912\\
\Rightarrow {m_{C{O_2}}} + {m_{{H_2}O}} = 19,488\\
{m_C} + {m_H} = {m_{hh}} = 4,64\\
X:{C_x}{H_y}\left\{ {\begin{array}{*{20}{c}}
{12x + y = 4,64\;\;\;\;\;\;\;}\\
{44x + 18.\frac{y}{2} = 19,488}
\end{array}} \right.\\
\Rightarrow \left\{ {\begin{array}{*{20}{c}}
{x = 0,348}\\
{y = 0,464}
\end{array}} \right.\\
x:y = 0,348:0,464 = 3:4\\
\Rightarrow {C_3}{H_4}
\end{array}\)