Bài 36: Luyện tập Hiđrocacbon thơm
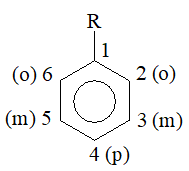
1. Danh pháp
a. Hệ thống
Số chỉ vị trí của nhóm ankyl + tên ankyl + benzen.
Tổng số chỉ vị trí: nhỏ nhất.
Tên ankyl: gọi theo bảng chữ cái.
b. Thay thế
1,2 thay bằng ortho
1,3 thay bằng meta
1,4 thay bằng para
Với R: nhóm ankyl
c. Thông thường
toluen, các xilen
2. Tính chất hóa học
a. Phản ứng thế
(thế nguyên tử hiđro)
Nhánh (ankyl): nhiệt độ. Vd: Brom khan.
Vòng: bột sắt.
Vd: halogen, axitric.
Quy tắc thế: Các ankyl benzen dễ tham gia phản ứng thế nguyên tử hiđro của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
b. Phản ứng cộng
Nhánh (có liên kết đôi, ba): dung dịch Br2, HBr, H2O.
Vòng: tạo vòng no: Hiđro.
c. Phản ứng oxi hóa
Hoàn toàn: phản ứng cháy.
Không hoàn toàn: ( phản ứng với dung dịch KMnO4 )
Vòng: không tác dụng. Bền với tác nhân oxi hóa là dung dịch KMnO4.
Nhánh:
No (ankyl): nhiệt độ cao.
Không no: nhiệt độ thường.
Bài 1:
Nhận biết các chất lỏng riêng biệt: ancol etylic, clorofom, benzen bằng 1 thuốc thử nào sau đây?
Hưỡng dẫn:
Dùng H2O ⇒ benzen phân lớp còn 2 chất còn lại tan.
Sau đó cho 2 chất còn lại vào benzen. Vì benzen tan rất kém trong nước và rượu nên sẽ phân lớp nếu có ancol etylic và tan tốt trong dung môi hữu cơ là clorofom.
Bài 2:
Cho sơ đồ phản ứng sau:
\(Toluen \xrightarrow[1:1]{+Cl_2\ (as)} X \xrightarrow[]{+NaOH,t^0} Y \xrightarrow[]{+CuO,t^0} Z \xrightarrow[]{dd\ AgNO_3/NH_3} T\)
Biết rằng X, Y, Z, T là những sản phẩm chính. Công thức cấu tạo của chất T là:
Hướng dẫn:
\({C_6}{H_5}C{H_3} \to {C_6}{H_5}C{H_2}Cl \to {C_6}{H_5}C{H_2}OH{C_6}{H_5}C{H_2}OH{C_6}{H_5}CHO \to {C_6}{H_5}COON{H_4}\)
Bài 3:
Cho 27,6 gam hợp chất thơm X có công thức C7H6O3 tác dụng với 800 ml dung dịch NaOH 1M thu được dung dịch Y. Để trung hòa toàn bộ Y cần 100 ml dung dịch H2SO4 1M thu được dung dịch Z. Khối lượng chất rắn khan thu được khi cô cạn dung dịch Z là:
Hướng dẫn:
Có nNaOH = 0,8 mol; n\(\tiny H_2SO_4\) trung hòa = 0,1 mol
⇒ nNaOH phản ứng với X = 0,8 – 0,1 × 2 = 0,6 mol = 3nX
⇒ X phải có CT là HCOO-C6H4-OH
⇒ Chất rắn sau cô cạn có: 0,1 mol Na2SO4; 0,2 mol HCOONa; 0,2 mol C6H4(ONa)2
⇒ m = 58,6 g
Bài 4:
Hỗn hợp chất X gồm các thành phần C, O, H chứa vòng benzen. Cho 6,9 gam X vào 360 ml dung dịch NaOH 0,5M (dư 20% so với lượng cần phản ứng) đến phản ứng hoàn toàn, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Mặt khác, đốt cháy hoàn toàn 6,9 g X cần vừa đủ 7,84 lít O2 (đktc) thu được 15,4 gam CO2. Biết X có công thức phân tử trùng với công thức đơn giản nhất. Giá trị của m là:
Hướng dẫn:
Khi đốt X: \(n_{O_2}= 0,35\) mol
⇒ theo ĐLBTKL: \(m_{H_2O} = m_X + m_{O_2} - m_{CO_2}\)
⇒ \(n_{H_2O} = 0,15\) mol và \(n_{CO_2} = 0,35\) mol
Trong X: \(n_C= 0,35\) mol;
\(n_H= 0,3\) mol; ⇒ \(n_C:n_H:n_O= 7:6:3\)
\(n_O=2n_{CO_2} +n_{H_2O} - 2n_{O_2}=0,15\) mol
Do X có CTPT trùng với CTDG nhất ⇒ X là C7H6O3
Có nNaOH = 0,18 mol ⇒ nNaOH phản ứng = 0,15 mol = 3nX
⇒ X có công thức cấu tạo là HCOO-C6H4-OH
HCOO-C6H4-OH + 3NaOH → HCOONa + C6H4(ONa)2 + 3H2O
⇒ m rắn = m NaOH dư + m HCOONa + mC6H4(ONa)2 = 12,3 g
1. Danh pháp
a. Hệ thống
Số chỉ vị trí của nhóm ankyl + tên ankyl + benzen.
Tổng số chỉ vị trí: nhỏ nhất.
Tên ankyl: gọi theo bảng chữ cái.
b. Thay thế
1,2 thay bằng ortho
1,3 thay bằng meta
1,4 thay bằng para
Với R: nhóm ankyl
c. Thông thường
toluen, các xilen
2. Tính chất hóa học
a. Phản ứng thế
(thế nguyên tử hiđro)
Nhánh (ankyl): nhiệt độ. Vd: Brom khan.
Vòng: bột sắt.
Vd: halogen, axitric.
Quy tắc thế: Các ankyl benzen dễ tham gia phản ứng thế nguyên tử hiđro của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
b. Phản ứng cộng
Nhánh (có liên kết đôi, ba): dung dịch Br2, HBr, H2O.
Vòng: tạo vòng no: Hiđro.
c. Phản ứng oxi hóa
Hoàn toàn: phản ứng cháy.
Không hoàn toàn: ( phản ứng với dung dịch KMnO4 )
Vòng: không tác dụng. Bền với tác nhân oxi hóa là dung dịch KMnO4.
Nhánh:
No (ankyl): nhiệt độ cao.
Không no: nhiệt độ thường.
Bài 1:
Nhận biết các chất lỏng riêng biệt: ancol etylic, clorofom, benzen bằng 1 thuốc thử nào sau đây?
Hưỡng dẫn:
Dùng H2O ⇒ benzen phân lớp còn 2 chất còn lại tan.
Sau đó cho 2 chất còn lại vào benzen. Vì benzen tan rất kém trong nước và rượu nên sẽ phân lớp nếu có ancol etylic và tan tốt trong dung môi hữu cơ là clorofom.
Bài 2:
Cho sơ đồ phản ứng sau:
\(Toluen \xrightarrow[1:1]{+Cl_2\ (as)} X \xrightarrow[]{+NaOH,t^0} Y \xrightarrow[]{+CuO,t^0} Z \xrightarrow[]{dd\ AgNO_3/NH_3} T\)
Biết rằng X, Y, Z, T là những sản phẩm chính. Công thức cấu tạo của chất T là:
Hướng dẫn:
\({C_6}{H_5}C{H_3} \to {C_6}{H_5}C{H_2}Cl \to {C_6}{H_5}C{H_2}OH{C_6}{H_5}C{H_2}OH{C_6}{H_5}CHO \to {C_6}{H_5}COON{H_4}\)
Bài 3:
Cho 27,6 gam hợp chất thơm X có công thức C7H6O3 tác dụng với 800 ml dung dịch NaOH 1M thu được dung dịch Y. Để trung hòa toàn bộ Y cần 100 ml dung dịch H2SO4 1M thu được dung dịch Z. Khối lượng chất rắn khan thu được khi cô cạn dung dịch Z là:
Hướng dẫn:
Có nNaOH = 0,8 mol; n\(\tiny H_2SO_4\) trung hòa = 0,1 mol
⇒ nNaOH phản ứng với X = 0,8 – 0,1 × 2 = 0,6 mol = 3nX
⇒ X phải có CT là HCOO-C6H4-OH
⇒ Chất rắn sau cô cạn có: 0,1 mol Na2SO4; 0,2 mol HCOONa; 0,2 mol C6H4(ONa)2
⇒ m = 58,6 g
Bài 4:
Hỗn hợp chất X gồm các thành phần C, O, H chứa vòng benzen. Cho 6,9 gam X vào 360 ml dung dịch NaOH 0,5M (dư 20% so với lượng cần phản ứng) đến phản ứng hoàn toàn, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn. Mặt khác, đốt cháy hoàn toàn 6,9 g X cần vừa đủ 7,84 lít O2 (đktc) thu được 15,4 gam CO2. Biết X có công thức phân tử trùng với công thức đơn giản nhất. Giá trị của m là:
Hướng dẫn:
Khi đốt X: \(n_{O_2}= 0,35\) mol
⇒ theo ĐLBTKL: \(m_{H_2O} = m_X + m_{O_2} - m_{CO_2}\)
⇒ \(n_{H_2O} = 0,15\) mol và \(n_{CO_2} = 0,35\) mol
Trong X: \(n_C= 0,35\) mol;
\(n_H= 0,3\) mol; ⇒ \(n_C:n_H:n_O= 7:6:3\)
\(n_O=2n_{CO_2} +n_{H_2O} - 2n_{O_2}=0,15\) mol
Do X có CTPT trùng với CTDG nhất ⇒ X là C7H6O3
Có nNaOH = 0,18 mol ⇒ nNaOH phản ứng = 0,15 mol = 3nX
⇒ X có công thức cấu tạo là HCOO-C6H4-OH
HCOO-C6H4-OH + 3NaOH → HCOONa + C6H4(ONa)2 + 3H2O
⇒ m rắn = m NaOH dư + m HCOONa + mC6H4(ONa)2 = 12,3 g