Bài Ôn tập chương IV trang 67, 68, 69 SBT Hóa 11 Chân trời sáng tạo
Alkane (A) có công thức phân tử C8H18. (A) tác dụng với chlorine đun nóng chỉ tạo một dẫn xuất monochloro duy nhất. Tên gọi của (A) là
BT 1
Alkane (A) có công thức phân tử C8H18. (A) tác dụng với chlorine đun nóng chỉ tạo một dẫn xuất monochloro duy nhất. Tên gọi của (A) là
A. octane. B. 2-methylheptane.
C. 2,2-dimethylhexane. D. 2,2,3,3-tetramethylbutane.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
Alkane tác dụng với chlorine đun nóng chỉ tạo một dẫn xuất monochloro duy nhất là alkane có tính đối xứng.
Lời giải chi tiết:
Alkane (A) có công thức phân tử C8H18 tác dụng với chlorine đun nóng chỉ tạo một dẫn xuất monochloro duy nhất là:
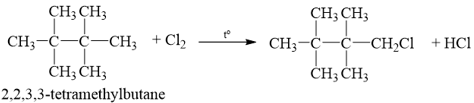
→ Chọn D.
BT 2
Cho các alkene sau: CH2=CH-CH3; (CH3)2C=C(CH3)2; CH3CH=CHCH3 và CH3CH=CHC2H5. Số alkene có đồng phân hình học là
A. 2. B. 4. C. 1. D. 3.
Phương pháp giải:
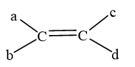
Với a, b, c, d là các nhóm thế.
Điệu kiện để alkene có đồng phân hình học: a ≠ b và c ≠ d.
Lời giải chi tiết:
Trong phân tử của hai alkene CH2=CH-CH2-CH3, (CH3)2C=C(CH3)2, ta thấy nguyên tử C trong liên kết đôi liên kết với hai nhóm thế giống nhau nên chúng không có đồng phân hình học.
Trong phân tử của hai alkene CH3CH=CHCH3 và CH3CH=CHC2H5, ta thấy nguyên tử C trong liên kết đôi liên kết với hai nhóm thế khác nhau nên chúng có đồng phân hình học.
→ Chọn A.
BT 3
Arene (B) có công thức phân tử C8H8. Khi có mặt bột sắt, (B) tác dụng với bromine tạo một sản phẩm thế monobromo duy nhất. Số công thức cấu tạo phù hợp với (B) là
A. 3. B. 4. C. 1. D. 2.
Phương pháp giải:
Quy tắc chung: Phản ứng thế nguyên tử H ở vòng thơm của các alkylbenzene dễ hơn benzene, ưu tiên xảy ra ở các vị trí ortho và para so với nhóm alkyl.
Lời giải chi tiết:
Khi có mặt bột sắt, (B) tác dụng với bromine tạo một sản phẩm thế monobromo duy nhất, chứng tỏ (B) có một nhóm thế ở vị trí para so với nhóm thế còn lại.
→ Chọn C.
BT 4
Hoá lỏng một alkane ở thể khí là cách để tối ưu hoá khả năng lưu trữ alkane trong các thiết bị. Để hoá lỏng một alkane ở thể khí, người ta có thể tiến hành trong điều kiện nhiệt độ thấp hơn nhiệt độ sôi của alkane. Ví dụ chúng ta có thể hoá lỏng propane ở nhiệt độ thấp hơn −42 °C hay methane xuống thấp hơn nhiệt độ –162 °C.
Tuy nhiên cách làm này rất tốn kém, không đạt hiệu quả kinh tế nên ít được áp dụng, mà thay vào đó người ta hoá lỏng alkane bằng cách nén chúng dưới áp suất cao. Để propane là chất lỏng ở nhiệt độ phòng, propane phải được giữ trong bình ở áp suất khoảng 850 kPa, tức khoảng 8,5 atm. Với methane phải khoảng 32 000 kPa, tức khoảng 320 atm và butane khoảng 230 kPa, tức khoảng 2,3 atm.
a) Alkane nào trong số 3 alkane đã nêu dễ hoá lỏng hơn?
b) Khí hoá lỏng nào trong số 3 khí hoá lỏng trên cần phải lưu trữ trong thiết bị thép cực bền? Vì sao?
Phương pháp giải:
a) Chất dễ hóa lỏng nhất là chất có áp suất hơi nhỏ nhất.
b) Khí cần lưu trữ trong thiết bị thép cực bền là khí có áp suất hóa hơi lớn nhất.
Lời giải chi tiết:
a) Butane có áp suất hơi nhỏ nhất (2,3 atm) so với các alkane trên nên butane dễ hóa lỏng nhất.
b) Methane có áp suất hơi lớn nhất (320 atm), do đó methane khó hóa hơi nhất so với các alkane trên. Để giữ được áp suất này, bình chứa methane phải là thép cực bền.
BT 5
Ở các nước Mỹ, Úc và một số quốc gia khác, khí hoá lỏng (LPG – Liquefied Petroleum Gas) được sử dụng nhiều làm nhiên liệu là propane hoá lỏng, Em hãy tính xem một bình khí hoá lỏng chứa 12 kg propane có thể cung cấp bao nhiêu lít khí propane ở 25 °C, 1 bar.
Phương pháp giải:
Tính số mol của propane, sau đó tính thể tích của propane ở điều kiện 25 °C, 1 bar (điều kiện chuẩn).
Lời giải chi tiết:
Công thức phân tử của propane là C3H8.
\[\begin{array}{l}{{\rm{n}}_{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}}} = \frac{{12 \times 1000}}{{44}} = \frac{{3000}}{{11}}{\rm{ }}({\rm{mol}})\\ \Rightarrow {{\rm{V}}_{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}}} = \frac{{3000}}{{11}} \times 24,79 \approx 6761{\rm{ (L)}}\end{array}\]
Vậy một bình khí hoá lỏng chứa 12 kg propane có thể cung cấp 6761 lít khí propane ở 25 °C, 1 bar.
BT 6
Quan sát biểu đồ thể hiện nhiệt độ sôi của 6 alkane đầu tiên.
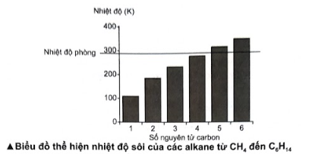
a) Có bao nhiêu alkane ở thể khí trong điều kiện thường?
b) Giải thích tại sao neopentane cũng ở thể khí trong điều kiện thường.
c) Cho biết ưu điểm và nhược điểm của propane và butane khi sử dụng chúng làm khí hoá lỏng?
Phương pháp giải:
a) Các alkane có nhiệt độ sôi thấp hơn nhiệt độ phòng là những alkane ở thể khí trong điều kiện thường.
b) Lực Van der Waals của các phân tử yếu, dẫn tới nhiệt độ sôi của phân tử đó thấp.
c) Dựa vào dữ kiện ở bài 4.4.
Lời giải chi tiết:
a) Các alkane có nhiệt độ sôi thấp hơn nhiệt độ phòng là CH4, C2H6, C3H8, C4H10. Do đó, ở điều kiện thường, 4 alkane này ở thể khí.
b) Công thức cấu tạo của neopentane:
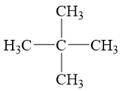
Neopentane có cấu trúc đối xứng cao, phân tử xem như có dạng hình cầu, do đó tương tác van der Waals giữa các phân tử neopentane rất yếu, dẫn đến nhiệt độ sôi của neopeatane là 9,5 °C.
Vì thế tuy có 5 nguyên tử carbon trong phân tử nhưng neopentane là một alkane ở thể khí trong điều kiện thường.
c)
|
|
Propane |
Butane |
|
Ưu điểm |
Sử dụng tốt ngay cả khi trời lạnh. |
- Vật dụng bảo quản không nhất thiết là thép vì butane có áp suất hóa hơi thấp (2,3 atm). - Độ an toàn cao vì butane khó bay hơi, nên có thể sử dụng trong phòng. |
|
Nhược điểm |
- Độ an toàn thấp vì propane dễ bay hơi, được sử dụng ngoài trời. - Vật dụng bảo quản phải là thép vì propane có áp suất hóa hơi cao (8,5 atm). |
Không sử dụng tốt khi trời lạnh. |
BT 7
Khi đốt cháy 1 mol propane toả ra lượng nhiệt là 2 220 kJ. Để đun nóng 1 gam nước tăng thêm 1 °C cần cung cấp nhiệt lượng là 4,2 J. Tính khối lượng propane cần dùng để đun 1 L nước từ 25°C lên 100 °C. Cho biết 75% nhiệt lượng toả ra khi đốt cháy propane dùng để nâng nhiệt độ của nước. Khối lượng riêng của nước là 1 g/mL.
Phương pháp giải:
Tính nhiệt lượng cần cung cấp để đun 1 L nước từ 25°C lên 100 °C. Tính số mol rồi tính khối lượng propane cần dùng từ nhiệt lượng trên.
Lời giải chi tiết:
Khối lượng của 1 L nước: \[{{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}} = {\rm{D}} \times {\rm{V}} = 1 \times 1000 = 1000{\rm{ }}({\rm{g}})\]
Nhiệt lượng cần cung cấp để đun 1 L nước từ 25°C lên 100 °C:
\[{\rm{Q}} = 1000 \times (100 - 25) \times 4,2 = 315000{\rm{ }}({\rm{J}}) = 315{\rm{ }}({\rm{kJ}})\]
Số mol của propane cần dùng để đun 1 L nước từ 25°C lên 100 °C: \[{{\rm{n}}_{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}}} = \frac{{315}}{{2220}} = \frac{{21}}{{148}}{\rm{ }}({\rm{mol}})\]
Khối lượng propane cần dùng để đun 1 L nước từ 25°C lên 100 °C (với hiệu suất đốt cháy propane là 75%):
\[{{\rm{m}}_{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}}} = \frac{{21}}{{148}} \times {\rm{44}} \times \frac{{100}}{{75}} \approx {\rm{ 8,32 }}({\rm{g}})\]
BT 8
Cục Quản Lí Thực Phẩm và Dược Phẩm Hoa Kì (FDA) đã công nhận ethylene là an toàn trong việc kích thích trái cây mau chín. Tuy nhiên khi vượt quá nồng độ cho phép, ví dụ đối với nồng độ 27 000 ppm, tức gấp khoảng 200 lần mức cần thiết để kích thích quá trình chín, một tia lửa điện có thể đốt cháy ethylene và gây ra vụ nổ chết người.
Trong phòng ủ chín, ethylene được sử dụng ở nồng độ 100 ppm – 150 ppm. Khối lượng ethylene cần thiết sử dụng để phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm ở 25 °C và 1 bar là bao nhiêu?
Phương pháp giải:
Tính thể tích của ethylene trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm ở 25 °C và 1 bar.
Tính số mol của ethylene từ thể tích trên rồi khối lượng ethylene cần dùng.
Chú ý: \[1{\rm{ }}{{\rm{m}}^3} = 1000{\rm{ L;}}\]1 ppm là một phần một triệu đơn vị thể tích (hoặc khối lượng); công thức phân tử của ethylene là C2H4.
Lời giải chi tiết:
Thể tích của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
\[{\rm{V}} = 50000 \times \frac{{140}}{{{{10}^6}}} = 7{\rm{ }}({\rm{L}})\]
Số mol của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
\[{\rm{n}} = \frac{{\rm{V}}}{{24,79}} = \frac{7}{{24,79}}{\rm{ }}({\rm{mol}})\]
Khối lượng của ethylene cần sử dụng trong phòng ủ chín có thể tích 50 m3 đạt nồng độ 140 ppm:
\[{\rm{m}} = \frac{7}{{24,79}} \times {\rm{28 }} \approx {\rm{7,91 }}({\rm{g}})\]
BT 9
(A) và (B) là 2 alkyne đồng phân có cùng công thức phân tử C4H6. Phân tích phổ hồng ngoại của (A) được kết quả sau:
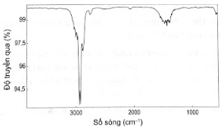
Gọi tên các alkyne (A) và (B) theo danh pháp thay thế.
Phương pháp giải:
Trong phổ hồng ngoại, peak đặc trưng của các alk-1-yne là peak khoảng 3300 cm-1.
Tên theo danh pháp thay thế của alkene hoặc alkyne không phân nhánh

Lời giải chi tiết:
Alkyne C4H6 có 2 đồng phân:
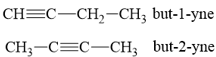
Đặc trưng phổ hồng ngoại của các alk-1-yne là có peak khoảng 3300 cm-1 do đó phổ hồng ngoại của alkyne (A) cho thấy (A) là but-2-yne và (B) là but-1-yne.
BT 10
Gọi tên các hợp chất sau theo danh pháp thay thế:
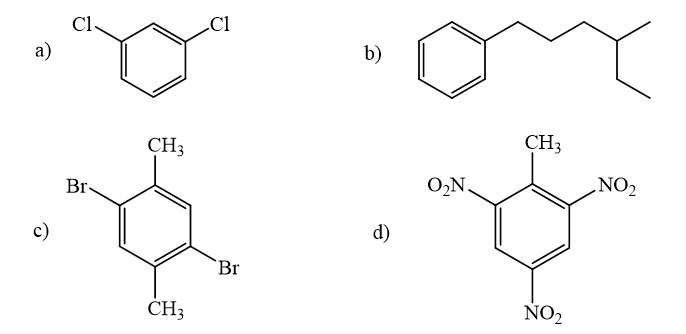
Phương pháp giải:
Nhiều hợp chất thơm được gọi theo tên thông thường (toluene, xylene,...). Khi gọi theo tên thay thế, vòng benzene được xem là mạch chính. Khi có hai nhóm thế trên vòng benzene, vị trí của chúng có thể được chỉ ra bằng các chữ số 1,2, 1,3 hay 1,4 hoặc bằng các chữ tương ứng là ortho (o), meta (m) hay para (p).
Lời giải chi tiết:
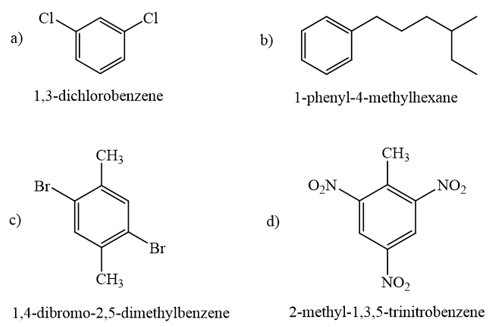
BT 11
a) Gọi tên hydrocarbon sau theo danh pháp thay thế:
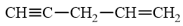
b) Khi cho hydrocarbon trên tác dụng với bromine trong CCl4 ở −20 °C thu được 4,5-dibromopent-1-yne theo phương trình phản ứng:
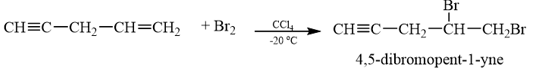
Nhận xét về tốc độ phản ứng cộng bromine vào liên kết đôi và liên kết ba. Rút ra kết luận.
Phương pháp giải:
a) Khi hydrocarbon vừa có liên kết đôi, vừa có liên kết ba, chú ý đánh số ưu tiên liên kết đôi hơn liên kết ba.
b) Alkene dễ cho phản ứng cộng (X2, HX, H2O) hơn so với alkyne.
Lời giải chi tiết:
a) Danh pháp thay thế của hydrocarbon:
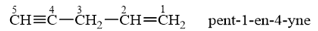
b) Dựa vào phương trình phản ứng, ta thấy tốc độ cộng bromine vào liên kết đôi lớn hơn rất nhiều so với vào liên kết ba. Điều này cũng phù hợp khi ethylene và acetylene đều có khả năng làm mất màu nước bromine ở ngay điều kiện thường, nhưng tốc độ mất màu của ethylene nhanh hơn so với acetylene. Như vậy alkene dễ cho phản ứng cộng (X2, HX, H2O) hơn so với alkyne.
BT 12
(H) và (K) là 2 hydrocarbon có cùng công thức phân tử C10H14 và đều không làm mất màu nước bromine, nhưng cả hai chất này đều làm mất màu dung dịch thuốc tím đã được acid hoá (ví dụ dung dịch KMnO4 trong H2SO4), trong đó (H) tạo terephthalic acid là sản phẩm hữu cơ duy nhất, (K) tạo 2 sản phẩm hữu cơ là terephthalic acid và chất (X). Xác định công thức cấu tạo của (H), (K), (X) và viết các phương trình phản ứng xảy ra.
Phương pháp giải:
Nhóm thế alkyl không no của arene làm mất màu nước bromine ở điều kiện thường.
Khi phản ứng với tác nhân oxi hóa mạnh như KMnO4, mạch nhánh alkyl thường bị gãy mạch ở nguyên tử carbon liên kết trực tiếp với vòng thơm khi tương tác với các chất oxi hoá mạnh.
Lời giải chi tiết:
(H) và (K) đều không làm mất màu nước bromine, chứng tỏ nhóm thế alkyl của (H) và (K) no.
- Với công thức C10H14, (H) không làm mất màu nước brom nhưng (H) làm mất màu dung dịch KMnO4 đã được acid hoá, tạo terephthalic acid là sản phẩm hữu cơ duy nhất nên (H) là một arene có công thức cấu tạo:
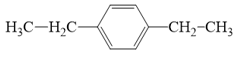
Phương trình hóa học của (H):
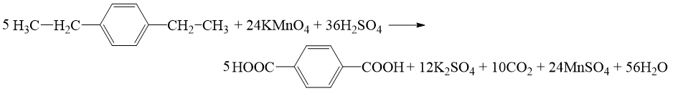
- (K) có công thức C10H14, (K) không làm mất màu nước bromine nhưng (K) làm mất màu dung dịch KMnO4 đã được acid hoá, tạo 2 sản phẩm hữu cơ là terephthalic acid và chất (X) nên (K) là một arene có công thức cấu tạo:
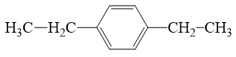
Phương trình hóa học của (K):
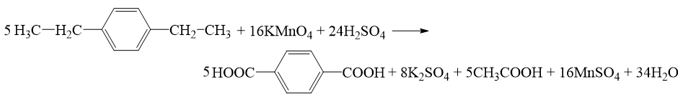
(X) là CH3COOH.
BT 13
So sánh điều kiện và khả năng phản ứng thế bromine vào vòng benzene của toluene với anisole (C6H5OCH3). Giải thích.
Phương pháp giải:
Nhóm thế -CH3 làm tăng hoạt vòng benzene, nhưng nhóm - OCH3 làm tăng hoạt vòng benzene mạnh hơn nhiều so với -CH3.
Lời giải chi tiết:
Nhóm methoxy (-OCH3) trong anisole làm tăng hoạt mạnh vòng benzene đến mức anisole nhanh chóng bromine hoá trong nước bromine mà không cần xúc tác, trong khi toluene cần có xúc tác là FeBr3 hoặc AlBr3.
BT 14
Giải thích tại sao m-xylene tham gia phản ứng nitro hoá nhanh hơn p-xylene 100 lần.
Phương pháp giải:
Công thức của m-xylene và p-xylene:
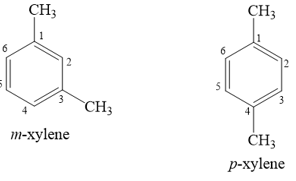
Khi trong vòng benzene đã có sẵn một nhóm alkyl, như –CH3, phản ứng thế vào vòng sẽ dễ dàng hơn, với hướng thế ưu tiên vào các vị trí ortho và para.
Lời giải chi tiết:
Với m-xylene, phản ứng thế hydrogen trên nhân benzene thuận lợi ở hai vị trí ortho (2 và 6) và một vị trí para (4).
Với p-xylene, phản ứng thế hydrogen trên nhân benzene chỉ thuận lợi ở hai vị trí ortho (2 và 6).
Điều này giúp m-xylene tham gia phản ứng nitro hoá nhanh hơn p-xylene 100 lần.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài Ôn tập chương IV trang 67, 68, 69 SBT Hóa 11 Chân trời sáng tạo timdapan.com"







