Bài 4. Nitrogen trang 15, 16, 17, 18 SBT Hóa 11 Kết nối tri thức
Khí nào phổ biến nhất trong khí quyển Trái Đất?
4.1
Khí nào phổ biến nhất trong khí quyển Trái Đất?
A. Oxygen. B. Nitrogen. C. Ozone. D. Argon.
Phương pháp giải:
Lời giải chi tiết:
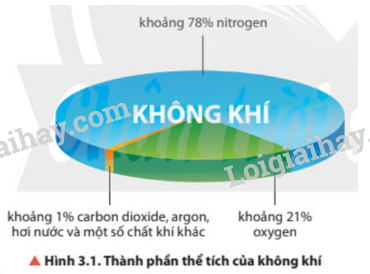
Khí nitrogen phổ biến nhất trong khí quyển Trái Đất.
→ Chọn B.
4.2
Công thức hoá học của diêm tiêu Chile là
A. Ca(NO3)2. B. NH4NO3. C.NH4Cl. D. NaNO3.
Phương pháp giải:
Sodium nitrate là hợp chất hoá học có công thức NaNO3. Muối này, còn được biết đến với cái tên, diêm tiêu Chile hay diêm tiêu Peru (do hai nơi này có lượng trầm tích lớn nhất).
Lời giải chi tiết:
Công thức hoá học của diêm tiêu Chile là NaNO3.
→ Chọn D.
4.3
Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là
A. chu kì 2, nhóm VA. B. chu kì 3, nhóm VA
C. chu kì 2, nhóm VIA. D. chu kì 3, nhóm IVA.
Phương pháp giải:
Nitrogen là nguyên tố nằm ở ô số 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
Lời giải chi tiết:
Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là chu kì 2, nhóm VA.
→ Chọn A.
4.4
Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ nào sau đây?
A. Tinh bột. B. Cellulose. C. Protein. D. Glucose.
Phương pháp giải:
Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri. Nitrogen còn có trong thành phần của protein, nucleic acid, ... và nhiều hợp chất hữu cơ khác
Lời giải chi tiết:
Trong tự nhiên, nguyên tố nitrogen tồn tại trong protein.
→ Chọn C.
4.5
Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là
A. 0 và +5. B. −3 và 0. C. -3 và +5. D. −2 và +4.
Phương pháp giải:
Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5.
Lời giải chi tiết:
Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là -3 và +5.
→ Chọn C.
4.6
Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị nào sau đây?
A. 14N. B. 13N. C. 15N. D. 12N.
Phương pháp giải:
Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: (99,63%) và (0,37%).
Lời giải chi tiết:
Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị 14N.
→ Chọn A.
4.7
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là
A. chất khử. B. chất oxi hoá. C. acid. D. base.
Phương pháp giải:
Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.
Lời giải chi tiết:
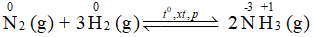
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen: N2 là chất oxi hóa.
→ Chọn B.
4.8
Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
A. NO. B. N2O. C. NH3. D. NO2.
Phương pháp giải:
Nitrogen monoxide được tạo thành từ nitrogen và oxygen khi có sấm sét.
Lời giải chi tiết:
Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là NO.
→ Chọn A.
4.9
Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là
A. chất oxi hoá. B. base. C. chất khử. D. acid
Phương pháp giải:
Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.
Lời giải chi tiết:
Tính khử của nitrogen được thể hiện khi N2 phản ứng với O2:
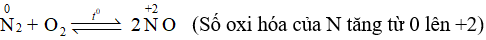
→ Chọn C.
4.10
Trong tự nhiên, phản ứng giữa nitrogen và oxygen (trong cơn mưa dông kèm sấm sét) là khởi đầu cho quá trình tạo và cung cấp loại phân bón nào cho cây?
A. Phân kali. B. Phân đạm ammonium.
C. Phân lân. D. Phân đạm nitrate.
Phương pháp giải:
Thực vật hấp thụ nitrogen ở dạng muối nitrate. Sau mỗi cơn mưa giông, đất hấp thụ một lượng ion nitrate, cung cấp đạm cho thực vật, giúp thực vật tươi tốt hơn.
Lời giải chi tiết:
Trong tự nhiên, phản ứng giữa nitrogen và oxygen (trong cơn mưa dông kèm sấm sét) là khởi đầu cho quá trình tạo và cung cấp loại phân đạm nitrate cho cây.
→ Chọn D.
4.11
Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar. B. 0,01 bar. C. 0,78 bar. D. 0,28 bar.
Phương pháp giải:
Áp suất riêng phần là áp suất của một loại khí trong hỗn hợp khí tác động lên môi trường xung quanh. Trong một hỗn hợp các chất khí, mỗi khí có một áp suất riêng phần hay áp suất từng phần là áp suất của khí đó nếu giả thiết rằng một mình nó chiếm toàn bộ thể tích của hỗn hợp ban đầu ở cùng một nhiệt độ. Áp suất tổng của một hỗn hợp khí lý tưởng là tổng của các áp suất riêng phần của những khí trong hỗn hợp.
Lời giải chi tiết:
Trong tự nhiên, áp suất của khí quyển là 1 bar. Khí nitrogen chiếm khoảng 78% thể tích không khí, cũng tương đương với 78% về áp suất.
\( \Rightarrow \) Áp suất riêng phần của khí nitrogen trong khí quyển là \(1 \times \frac{{78}}{{100}} = 0,78{\rm{ (bar)}}\)
→ Chọn C.
4.12
Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14N (99,63%) và 15N (0,37%). Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.
Phương pháp giải:
Lời giải chi tiết:
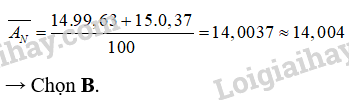
4.13
Số liên kết sigma (σ) và số liên kết pi (π) trong phân tử nitrogen lần lượt là
A. 2 và 1. B. 0 và 3. C. 3 và 0. D. 1 và 2.
Phương pháp giải:
Trong phân tử nitrogen có liên kết ba, trong liên kết ba có 1 liên kết sigma (σ) và 2 liên kết pi (π).
Lời giải chi tiết:
Số liên kết sigma (σ) và số liên kết pi (π) trong phân tử nitrogen lần lượt là 1 và 2.
→ Chọn D.
4.14
Bậc liên kết và năng lượng liên kết trong phân tử nitrogen tương ứng là
A. 2 và 418 kJ/mol. B. 1 và 167 kJ/mol.
C. 1 và 386 kJ/mol. D. 3 và 945 kJ/mol.
Phương pháp giải:
Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
Lời giải chi tiết:
Phân tử nitrogen có công thức cấu tạo là N≡N, là liên kết bậc ba và năng lượng liên kết trong phân tử nitrogen tương ứng là 945 kJ/mol.
→ Chọn D.
4.15
Nitrogen thể hiện tính khử trong phản ứng nào sau đây?
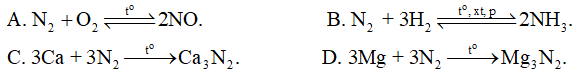
Phương pháp giải:
Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.
Lời giải chi tiết:

4.16
Nhận định nào sau đây về phân tử nitrogen là đúng?
A. Có ba liên kết đơn bền vững.
B. Chứa nguyên tử nitrogen có số oxi hoá là -3.
C. Có liên kết cộng hoá trị có cực.
D. Thể hiện cả tính oxi hoá và tính khử.
Phương pháp giải:
Trong phân tử nitrogen:
+ Chứa liên kết ba, đây là liên kết cộng hóa trị không cực.
+ Nguyên tử nitrogen có số oxi hóa là 0.
+ Thể hiện cả tính oxi hóa và tính khử.
Lời giải chi tiết:
Nhận định A sai vì phân tử nitrogen chứa liên kết ba.
Nhận định B sai vì nguyên tử nitrogen trong phân tử nitrogen có số oxi hoá là 0.
Nhận định C sai vì liên kết trong phân tử nitrogen là liên kết cộng hóa trị không cực.
Nhận định D đúng vì số oxi hóa của N có thể có là -3; 0; +1; +2; +3; +4; +5. Trong khi số oxi hóa của N trong phân tử nitrogen là 0, có thể giảm để thể hiện tính oxi hóa và tăng để thể hiện tính khử.
→ Chọn D.
4.17
Nhận định nào sau đây về đơn chất nitrogen là sai?
A. Không màu và nhẹ hơn không khí.
B. Hoả hợp với oxygen ở nhiệt độ cao hoặc tia lửa điện.
C. Thể hiện tính oxi hoá mạnh ở điều kiện thường.
D. Khó hoá lỏng và ít tan trong nước.
Phương pháp giải:
Ở điều kiện thường nitrogen là chất khí không màu, không mùi, không vị, nhẹ hơn không khí, hóa lỏng ở -196 oC, hóa rắn ở -210 oC, rất ít tan trong nước.
Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol). Do đó ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học).
Phản ứng hóa hợp với oxygen của nitrogen cần thực hiện ở nhiệt cao hoặc tia lửa điện.
Lời giải chi tiết:
Nhận định C sai vì ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học.
→ Chọn C.
4.18
Trong nghiên cứu, khí nitrogen thường được dùng để tạo bầu khí quyển trơ dựa trên cơ sở nào?
A. Nitrogen có tính oxi hoá mạnh. B. Nitrogen rất bền với nhiệt.
C. Nitrogen khó hoá lỏng. D. Nitrogen không có cực.
Phương pháp giải:
Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol). Do đó ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học).
Lời giải chi tiết:
Trong nghiên cứu, khí nitrogen thường được dùng để tạo bầu khí quyển trơ vì nitrogen rất bền với nhiệt.
→ Chọn B.
4.19
Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
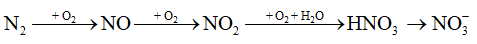
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3. B. 1. C. 4. D. 2.
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Lời giải chi tiết:
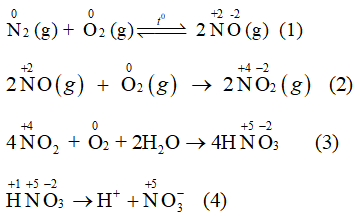
Các phản ứng (1), (2), (3) có sự thay đổi số oxi hóa của một số nguyên tố. Do đó các phản ứng này là phản ứng oxi hóa khử.
→ Chọn A.
4.20
Tính phân tử khối trung bình của không khí, giả thiết thành phần không khí: 78% nitrogen, 21% oxygen và 1% argon.
Phương pháp giải:
\(\overline {{{\rm{M}}_{{\rm{kk}}}}} = \frac{{\% {{\rm{N}}_{\rm{2}}}{\rm{.}}{{\rm{M}}_{{{\rm{N}}_{\rm{2}}}}} + \% {{\rm{O}}_{\rm{2}}}{\rm{.}}{{\rm{M}}_{{{\rm{O}}_{\rm{2}}}}} + \% {\rm{Ar}}{\rm{.}}{{\rm{M}}_{{\rm{Ar}}}}}}{{100}}\
Lời giải chi tiết:
\(\overline {{{\rm{M}}_{{\rm{kk}}}}} = \frac{{78.28 + 21.32 + 1.40}}{{100}} = 28,96\)
4.21
Tính khối lượng riêng (g/L) của không khí ở điều kiện chuẩn, giả thiết thành phần không khí: 78% nitrogen, 21% oxygen và 1% argon.
Phương pháp giải:
Tính khối lượng không khí và thể tích không khí ở điều kiện chuẩn.
Sử dụng công thức \[{\rm{D = }}\frac{{\rm{m}}}{{\rm{V}}}\]
Lời giải chi tiết:
Với thành phần không khí: 78% nitrogen, 21% oxygen và 1% argon, ta có: \(\overline {{{\rm{M}}_{{\rm{kk}}}}} = \frac{{78.28 + 21.32 + 1.40}}{{100}} = 28,96\)
Xét 1 mol không khí, ta có: \({{\rm{m}}_{{\rm{kk}}}} = 1 \times 28,96 = 28,96{\rm{ (g); }}{{\rm{V}}_{{\rm{kk}}}} = 1 \times 24,79 = 24,79{\rm{ (L)}}\)
\( \Rightarrow \)Khối lượng riêng của không khí ở điều kiện chuẩn: \({{\rm{D}}_{{\rm{kk}}}}{\rm{ = }}\frac{{{{\rm{m}}_{{\rm{kk}}}}}}{{{{\rm{V}}_{{\rm{kk}}}}}} = \frac{{28,96}}{{24,79}} \approx 1,168{\rm{ }}({\rm{g/L}})\)
4.22
Trong công nghiệp, ammonia được sản xuất theo phản ứng pha khí:
\({{\rm{N}}_{\rm{2}}}(g) + 3{{\rm{H}}_2}(g) \to 2{\rm{N}}{{\rm{H}}_3}(g){\rm{ }}{\Delta _r}{\rm{H}}^\circ \)
Cho biết các giá trị năng lượng liên kết Eb (kJ.mol-1):
|
Liên kết |
N≡N |
H-H |
N-H |
|
Eb |
945 |
436 |
386 |
a) Tính nhiệt phản ứng ∆rH° của phản ứng ở điều kiện chuẩn, nhận xét về dấu và độ lớn của giá trị tìm được.
b) Tính nhiệt tạo thành ∆fH° (kJ.mol-1) của NH3 (g).
Phương pháp giải:
a) Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(cd) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\)
b) Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(cd) }}\)
Nhiệt tạo thành của đơn chất bằng 0.
Lời giải chi tiết:
a) \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(cd) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\)
\(\begin{array}{l}{\rm{ = }}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{N}}_{\rm{2}}}{\rm{) + 3}}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{) - 2}}{{\rm{E}}_{\rm{b}}}{\rm{(N}}{{\rm{H}}_3}{\rm{)}}\\ = {{\rm{E}}_{\rm{b}}}_{{\rm{(N}} \equiv {\rm{N)}}}{\rm{ + 3}}{{\rm{E}}_{\rm{b}}}_{{\rm{(H - H)}}}{\rm{ - 2}}{\rm{.3}}{\rm{.}}{{\rm{E}}_{\rm{b}}}{}_{{\rm{(N - H)}}}\\ = 1.945 + 3.436 - 6.386 = - 63{\rm{ (kJ)}}\end{array}\)
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0\)< 0 \( \Rightarrow \)Phản ứng trên là phản ứng tỏa nhiệt.
b) \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(cd) }}\)
\(\begin{array}{l} \Leftrightarrow {\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 2{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{H}}_3}{\rm{)}} - [{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{N}}_{\rm{2}}}{\rm{) + 3}}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{H}}_2}{\rm{)]}}\\ \Leftrightarrow - 63 = 2{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{H}}_3}{\rm{)}} - (0 + 3.0)\\ \Rightarrow {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{H}}_3}{\rm{)}} = \frac{{ - 63}}{2} = - 31,5{\rm{ (kJ/mol)}}\end{array}\)
4.23
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 3. Nung nóng X trong bình kín (450 oC, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Phương pháp giải:
Tính số mol giảm của phản ứng rồi tính hiệu suất của phản ứng theo N2 hoặc H2. Với N2 và H2 có tỉ lệ mol tương ứng là 1 : 3, phản ứng vừa đủ theo tỉ lệ trên nên có thể tính hiệu suất của phản ứng theo N2 hoặc H2.
Lời giải chi tiết:
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 3.
Chọn \({{\rm{n}}_{{{\rm{N}}_{\rm{2}}}}} = 1{\rm{ (mol)}};{\rm{ }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}} = 3{\rm{ }}({\rm{mol}})\)
\( \Rightarrow \)Số mol khí ban đầu là: \(1 + 3 = 4{\rm{ (mol)}}\)
Gọi x (mol) là số mol N2 phản ứng.
Xét cân bằng:
\({{\rm{N}}_2}\left( g \right){\rm{ }} + {\rm{ }}3{{\rm{H}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{N}}{{\rm{H}}_3}\left( g \right){\rm{ }}\)
Ban đầu (mol): 1 3 0
Phản ứng (mol): x → 3x → 2x
Cân bằng (mol): 1 - x 3 – 3x 2x
\( \Rightarrow \)Số mol khí sau phản ứng: \({\rm{(1}} - {\rm{x}}){\rm{ + (3 -- 3x) + 2x = 4}} - {\rm{2x (mol)}}\)
\( \Rightarrow \)Số mol khí giảm so với ban đầu: \(4 - (4 - 2{\rm{x}}) = 2{\rm{x (mol)}}\)
Ta có: hỗn hợp khí sau phản ứng có số mol giảm 5% so với ban đầu.
\( \Leftrightarrow 2{\rm{x}} = \frac{5}{{100}} \times 4 \Rightarrow {\rm{x}} = 0,1{\rm{ (mol)}}\)
\(\begin{array}{l} \Rightarrow {{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{p/u}}}} = {\rm{x}} = 0,1{\rm{ }}{({\rm{mol}})^{}}\\ \Rightarrow {\rm{H}} = \frac{{{{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{p/u}}}}}}{{{{\rm{n}}_{{{\rm{N}}_{\rm{2}}}{\rm{bd}}}}}} \times 100\% = \frac{{0,1}}{1} \times 100\% = 10\% \end{array}\)
4.24
Cho cân bằng ở 1 650 °C: \({{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{NO}}\left( g \right){\rm{ }}{{\rm{K}}_{\rm{C}}} = {4.10^{ - 4}}\)
Thực hiện phản ứng trên với một hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 4 : 1. Tính hiệu suất của phản ứng khi hệ cân bằng ở 1 650 °C.
Phương pháp giải:
Tính nồng độ của O2 phản ứng rồi tính hiệu suất theo O2. Với tỉ lệ mol giữa N2 và O2 là 4 : 1, N2 bị dư nên ta tính hiệu suất theo O2.
Lời giải chi tiết:
Hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 4 : 1.
Chọn \({{\rm{C}}_{{{\rm{N}}_{\rm{2}}}}} = {\rm{ 4 (M); }}{{\rm{C}}_{{{\rm{O}}_{\rm{2}}}}} = 1{\rm{ }}({\rm{M}})\)
Gọi x (M) là nồng độ mol của O2 phản ứng.
\({{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{NO}}\left( g \right){\rm{ }}\left( 1 \right)\)
Ban đầu (M): 4 1 0
Phản ứng (M): x → x → 2x
Cân bằng (M): 4 - x 1 – x 2x
Ở 1650 °C, ta có: \({{\rm{K}}_{\rm{C}}} = {4.10^{ - 4}}\)
\(\begin{array}{l} \Leftrightarrow \frac{{{{{\rm{[NO]}}}^{\rm{2}}}}}{{{\rm{[}}{{\rm{N}}_{\rm{2}}}{\rm{][}}{{\rm{O}}_2}{\rm{]}}}} = {4.10^{ - 4}}\\ \Leftrightarrow \frac{{{{{\rm{(2x)}}}^2}}}{{(4 - {\rm{x}})(1 - {\rm{x}})}} = {4.10^{ - 4}}\\ \Rightarrow {\rm{x}} \approx 0,0{\rm{2 (M)}}\end{array}\)
\(\begin{array}{l} \Rightarrow {{\rm{C}}_{{{\rm{O}}_{\rm{2}}}{\rm{p/u}}}} = {\rm{x}} = 0,02{\rm{ }}({\rm{M}})\\ \Rightarrow {\rm{H}} = \frac{{{{\rm{C}}_{{{\rm{O}}_{\rm{2}}}{\rm{p/u}}}}}}{{{{\rm{C}}_{{{\rm{O}}_{\rm{2}}}{\rm{bd}}}}}} \times 100\% = \frac{{0,02}}{1} \times 100\% = 2\% \end{array}\)
4.25
Sau mỗi chu trình tổng hợp ammonia đều thực hiện tách ammonia khỏi hỗn hợp khí gồm: nitrogen, hydrogen và ammonia. Sau đó, nitrogen và hydrogen lại được dẫn về thực hiện vòng tuần hoàn mới.
Cho biết nhiệt độ sôi nitrogen, hydrogen và ammonia lần lượt là –196 °C, −253 °C và −33 °C.
Đề xuất phương pháp vật lí tách ammonia khỏi hỗn hợp đó.
Phương pháp giải:
3 khí trên có nhiệt độ sôi khác nhau, trong đó ammonia có nhiệt độ sôi cao nhất, do đó có thể tách ammonia khỏi hỗn hợp, bằng cách hóa lỏng ammonia trước.
Lời giải chi tiết:
Từ dữ kiện về nhiệt độ sôi cho thấy ammonia lỏng có nhiệt độ sôi cao nhất, ngược lại khí ammonia sẽ dễ bị hoá lỏng nhất. Như vậy, nếu giảm nhiệt độ hỗn hợp xuống thấp hơn – 33 °C vài độ, ví dụ ở – 40 °C thì toàn bộ khí ammonia sẽ hoá lỏng và được tách ra. Trong khi đó, ở – 40 °C thì nitrogen và hydrogen vẫn ở trạng thái khí được dẫn về thực hiện vòng tuần hoàn mới.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 4. Nitrogen trang 15, 16, 17, 18 SBT Hóa 11 Kết nối tri thức timdapan.com"







