Bài 1. Mở đầu về cân bằng hóa học trang 3, 4, 5, 6 SBT Hóa 11 Cánh diều
Điền từ ngữ thích hợp vào các chỗ trống trong mỗi phát biểu sau:
1.1
Điền từ ngữ thích hợp vào các chỗ trống trong mỗi phát biểu sau:
a) Phản ứng thuận nghịch là phản ứng hoá học trong đó ở cùng điều kiện, xảy ra ...(1)... sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển ...(2)... thành ...(3)....
b) Trạng thái cân bằng của mọi phản ứng thuận nghịch luôn có tốc độ phản ứng thuận ...(1)... tốc độ phản ứng nghịch, các phản ứng thuận và nghịch luôn diễn ra. Như vậy, cân bằng hoá học là ...(2)....
c) Với một phản ứng hoá học, khi hằng số cân bằng rất lớn so với 1 thì ở trạng thái cân bằng, nồng độ các chất sản phẩm ...(1)... nồng độ ...(2)...
Phương pháp giải:
Dựa vào khái niệm về phản ứng thuận nghịch
Lời giải chi tiết:
Phản ứng thuận nghịch là phản ứng hoá học trong đó ở cùng điều kiện, xảy ra (1) đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển (2) chất sản phẩm thành (3) chất phản ứng
b) Trạng thái cân bằng của mọi phản ứng thuận nghịch luôn có tốc độ phản ứng thuận (1) bằng tốc độ phản ứng nghịch, các phản ứng thuận và nghịch luôn diễn ra. Như vậy, cân bằng hoá học là (2) cân bằng động.
c) Với một phản ứng hoá học, khi hằng số cân bằng rất lớn so với 1 thì ở trạng thái cân bằng, nồng độ các chất sản phẩm (1) lớn hơn rất nhiều so với nồng độ (2) chất tham gia
1.2
Quan sát Hình 1.1 và ghép mỗi đối tượng ở cột A với một mô tả thích hợp ở
cột B.
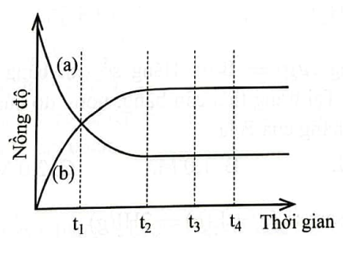
Hình 1.1. Biến thiên nồng độ chất phản ứng và chất sản phẩm theo thời gian
|
Cột A |
Cột B |
|
a) Đường a |
1. không phải là thời điểm bắt đầu trạng thái cân bằng |
|
b) t1 |
2. mô tả biến thiên nồng độ chất sản phẩm theo thời gian. |
|
c) Đường b |
3. là thời điểm phản ứng đạt trạng thái cân bằng. |
|
d) t2 |
4. mô tả biến thiên nồng độ chất phản ứng theo thời gian. |
Phương pháp giải:
Theo thời gian nồng độ chất tham gia giảm dần, nồng độ chất sản phẩm tăng dần.
Lời giải chi tiết:
a-4 ; b-1 ; c-2 ; d-3
1.3
Quan sát Hình 1.2 và chọn phát biểu đúng.
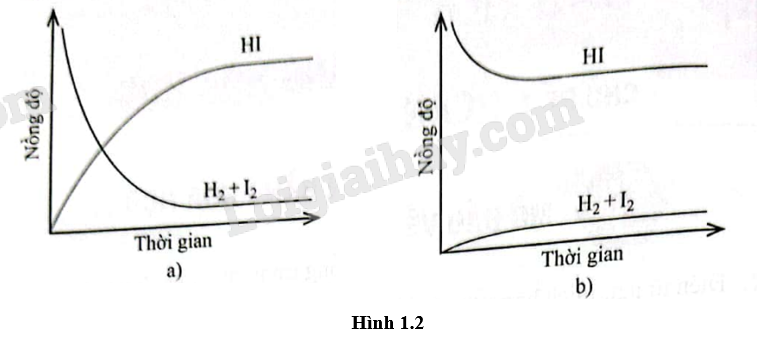
A. Cả hai đồ thị đều mô tả phản ứng đã đạt đến trạng thái cân bằng.
B. Cả hai đồ thị đều không mô tả phản ứng đã đạt đến trạng thái cân bằng.
C. Chỉ đồ thị (a) mô tả phản ứng đã đạt đến trạng thái cân bằng.
D. Chỉ đồ thị (b) mô tả phản ứng đã đạt đến trạng thái cân bằng.
Phương pháp giải:
Khi phản ứng cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch nên nồng độ các chất không thay đổi
Lời giải chi tiết:
Đáp án A
1.4
Biểu thức nào sau đây là biểu thức hằng số cân bằng (Kc) của phản ứng:
\(C(s) + 2{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{H_4}(g)\)
\(\begin{array}{l}A.{K_c} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}{H_2}]}}\\B.{K_c} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}C{\rm{][}}{H_2}{]^2}}}\\C.{K_c} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}C{\rm{][}}{H_2}]}}\\D.{K_c} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}{H_2}]}}\end{array}\)
Phương pháp giải:
biểu thức tính Kc không áp dụng cho chất rắn.
Lời giải chi tiết:
Đáp án D
1.5
Cho phản ứng A(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) B(g). Hằng số cân bằng của phản ứng đã cho là Kc = 1,0.103. Tại trạng thái cân bằng, nồng độ của chất A là 1,0.10-3 M thì nồng độ cân bằng của B là
A. 1,0.10-3 M.
B. 1,0 M.
C. 2,0 M.
D. 1,0.103 M.
Phương pháp giải:
A và B đều là chất khí nên sử dụng công thức tính Kc
Lời giải chi tiết:
\(Kc = \frac{{{\rm{[}}B{\rm{]}}}}{{{\rm{[}}A]}}\) → [B] = Kc.[A] = 1,0.103. 1,0.10-3 = 1 M
Đáp án B
1.6
Xét cân bằng sau: H2(g) +I2(g)\( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2HI(g)
a) Hoàn thành bảng sau
|
Nhiệt độ (oC) |
[H2] (mol.L-1) |
[I2] (mol.L-1) |
[HI] (mol.L-1) |
Kc |
|
25 |
0.0355 |
0.0388 |
0.9220 |
...(1)... |
|
340 |
...(2)... |
0.0455 |
0,3870 |
9.6 |
|
445 |
0.0485 |
0.0468 |
...(3)... |
50.2 |
b*) Hãy cho biết khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều nào?
Phương pháp giải:
Sử dụng công thức tính \(Kc = \frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{H_2}]{\rm{[}}{I_2}]}}\)
Lời giải chi tiết:
a) Tại 25oC : \(Kc = \frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{H_2}]{\rm{[}}{I_2}]}}\) = \(\frac{{0,{{9220}^2}}}{{0,03355.0,0388}}\)= 617,1657
Tại 340oC : [H2] = \(\frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{K_{c{\rm{]}}}}{\rm{[}}{I_2}]}} = \frac{{0,{{3870}^2}}}{{9,6.0,045}}\)= 0,3428 M (2)
Tại 445oC : [HI] = \(\sqrt {{K_c}{\rm{[}}{H_2}]{\rm{[}}{I_2}]} = \sqrt {50,2.0,0485.0,0468} \) = 0,3376 M (3)
b) Khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều nghịch do nồng độ HI giảm, đồng thời nồng độ H2 và I2 tăng
1.7
Phát biểu nào sau đây về phản ứng ở trạng thái cân bằng là không đúng?
A. Các phản ứng thuận và phản ứng nghịch diễn ra với tốc độ như nhau.
B. Nồng độ của chất phản ứng và chất sản phẩm không thay đổi.
C. Nồng độ của các chất phản ứng bằng nồng độ của các chất sản phẩm.
D. Các phản ứng thuận và nghịch tiếp tục xảy ra.
Phương pháp giải:
Dựa vào khái niệm về trạng thái cân bằng của phản ứng
Lời giải chi tiết:
Đáp án C
1.8
Xét cân bằng sau:
2SO2(g) + O2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2SO3(g)
Nếu tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào lượng SO2 thêm vào.
D. Không thay đổi.
Phương pháp giải:
Nguyên lý chuyên dịch cân bằng Le Chatelier
Lời giải chi tiết:
Khi tăng áp suất, chuyển dịch sẽ theo chiều làm giảm số mol khí. Đối với phản ứng trên số mol khí phản ứng là 1 N2 + 3 H2 = 4. Số mol sản phẩm là 2 NH3 = 2 nên khi tăng áp suất phản ứng chuyển dịch theo chiều thuận
Đáp án B
1.9
Xét cân bằng sau diễn ra trong một piston ở nhiệt độ không đổi:
N2(g) + 3H2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NH3(g)
Nếu nén piston thì cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào piston bị nén nhanh hay chậm.
D. Không thay đổi.
Phương pháp giải:
Nguyên lý chuyên dịch cân bằng Le Chatelier
Lời giải chi tiết:
Khi tăng áp suất, chuyển dịch sẽ theo chiều làm giảm số mol khí. Đối với phản ứng trên số mol khí phản ứng là 1 N2 + 3 H2 = 4. Số mol sản phẩm là 2 NH3 = 2 nên khi tăng áp suất phản ứng chuyển dịch theo chiều thuận.
Đáp án B
1.10
Đối với phản ứng sau, cân bằng sẽ bị ảnh hưởng như thế nào khi tăng nhiệt độ (các điều kiện khác giữ không đổi)?
\[{H_2}(g) + \frac{1}{2}{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2}O(l)\] \({\Delta _r}H_{298}^0 = - 286kJ\)
A. Cân bằng chuyển dịch sang phải.
B. Cân bằng chuyển dịch sang trái.
C. Không thay đổi.
D. Không dự đoán được sự chuyển dịch cân bằng.
Phương pháp giải:
Nguyên lý chuyên dịch cân bằng Le Chatelier
Lời giải chi tiết:
\({\Delta _r}H_{298}^0 = - 286kJ\)< 0 nên phản ứng trên là phản ứng tỏa nhiệt. Khi tăng nhiệt độ cân chuyển dịch sẽ theo chiều làm giảm nhiệt độ tức là theo chiều nghịch.
Đáp án B
1.11
Trong phản ứng nào sau đây sự tăng áp suất sẽ dẫn tới cân bằng chuyển dịch
sang trái (các điều kiện khác coi như không thay đổi)?
A. CaCO3(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CaO(s) + CO2(g)
B. CO(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H2(g) + CO2(g)
C. 2H2(g) + O2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2H2O(1)
D. C(s) + O2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO2(g)
Phương pháp giải:
Nguyên lý chuyên dịch cân bằng Le Chatelier
Lời giải chi tiết:
Khi tăng áp suất, chuyển dịch sẽ theo chiều làm giảm số mol khí.
CaCO3(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CaO(s) + CO2(g) mol khí phản ứng là 0, mol khí sản phẩm là 1.
Đáp án A
1.12
Viết biểu thức hằng số cân bằng cho các phản ứng dưới đây:
a) 2Hg(l) + O2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2HgO(s)
b) CH3COOH (aq) + С2H5OH(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CH3COOC2H5(aq) + H2O(l)
c) H2(g) + CO2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CO(g) + H2O(g)
d) 2FeCl3(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2FeCl2(s) + Cl2(g)
Phương pháp giải:
Biểu thức tính Kc không áp dụng cho chất rắn và nước.
Lời giải chi tiết:
\(\begin{array}{l}a){K_c} = \frac{1}{{{{{\rm{[}}Hg{\rm{]}}}^2}[{H_2}]}}\\b){K_c} = \frac{{{\rm{[}}C{H_3}COO{C_2}{H_5}]}}{{{\rm{[}}C{H_3}COOH]{\rm{[}}{C_2}{H_5}OH]}}\\c){K_c} = \frac{{{\rm{[}}CO]}}{{{\rm{[}}{H_2}]{\rm{[}}C{O_2}]}}\\d){K_c} = {\rm{[C}}{{\rm{l}}_{\rm{2}}}{\rm{]}}\end{array}\)
1.13
Xét phản ứng:
H2(g) + I2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2HI(g)
Một hỗn hợp phản ứng chứa trong bình dung tích 3,67 lít ở một nhiệt độ nhất định; ban đầu chứa 0,763 gam H2 và 96,9 gam I2. Ở trạng thái cân bằng, bình chứa 90,4 gam HI. Tính hằng số cân bằng (Kc) cho phản ứng ở nhiệt độ này.
Phương pháp giải:
Viết pthh, áp dụng biểu thức tính hằng số cân bằng
Lời giải chi tiết:
|
nH2 \( = \frac{{0,763}}{2}\)= 0,3815 mol |
nI2 = \(\frac{{96,9}}{{254}}\)= 0,3815 mol |
nHI = \(\frac{{90,4}}{{128}}\)= 0,7062 mol |
|||
|
CH2 = \(\frac{{0,3815}}{{3,67}}\)= 0,1040 M |
CHI = \(\frac{{0,7062}}{{3,76}}\)= 0,1924 M |
|
|||
|
|
H2(g) + |
I2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) |
2HI(g) |
||
|
Ban đầu |
0,1040 |
0,1040 |
0 |
||
|
Phản ứng |
x |
x |
2x |
||
|
Cân bằng |
0,1040 - x |
0,1040 - x |
0,1924 |
||
Ta có 2x = 0,1924 → x = 0,0962
Khi phản ứng cân bằng cân bằng
[H2] = 0,1040 – x = 0,0078M
[I2] = 0,1040 – x = 0,0078M
\(Kc = \frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{H_2}]{\rm{[}}{I_2}]}}\) = \(\frac{{0,{{1924}^2}}}{{0,0078.0,0078}}\)= 608,4
1.14
Lượng đường glucose trong máu người thường ổn định ở nồng độ khoảng 0,1%. Khi ta ăn tinh bột, glucose sẽ được sinh ra trong cơ thể; còn khi cơ thể vận động và hoạt động trí não, glucose bị tiêu thụ.
a) Em hãy tìm hiểu để giải thích vì sao lượng glucose trong máu luôn ổn định ở mức khoảng 0,1%.
b) Theo em, khi cơ thể hoạt động thể thao hay khi ăn uống sẽ xảy ra đồng thời hai quá trình sinh ra và mất đi glucose? Giải thích. Sự ổn định của glucose trong máu có thể được coi là trạng thái cân bằng hoá học không? Nếu có, hãy đề xuất cân bằng đó.
Phương pháp giải:
Dựa vào kiến thức về phản ứng thuận nghịch
Lời giải chi tiết:
a) Tuyến tuỵ có vai trò quan trọng trong việc ổn định lượng đường trong máu bởi tuyến này sản xuất hai loại hormone: insulin và glucagon. Hoạt động ăn uống sinh ra glucose, lúc này insulin sẽ có vai trò chuyển glucose thành glycogen tích trữ trong gan. Khi cơ thể hoạt động sẽ tiêu thụ glucose, lúc này glucagon sẽ có vai trò chuyển glycogen trong gan thành glucose.
b) Cả hai thời điểm đều xảy ra đồng thời hai quá trình sinh ra và mất đi glucose.
Khi hoạt động thể thao: tiêu hao glucose nhưng lại được sinh ra bổ sung từ glycogen.
Khi ăn uống: sinh ra glucose do ăn uống và mất đi glucose do hoạt động của một số bộ phận (tay, miệng, não bộ,...).
Có thể coi đó là cân bằng hoá học đặc biệt do sự sinh ra và mất đi glucose liên quan đến các phản ứng hoá học. Ví dụ: Glucose -> Glycogen
1.15
Carbon monoxide thay thế oxygen trong hemoglobin đã bị oxi hoá theo phản ứng:
HbO2 (aq) + CO(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) HbCO (aq) + O2(aq)
Tại nhiệt độ trung bình trong cơ thể, hằng số cân bằng của phản ứng trên là Kc = 170.
Giả sử một hỗn hợp không khí bị ô nhiễm carbon monoxide ở mức 0,1% (theo thể tích). Coi không khí chứa 20,0% oxygen về thể tích; tỉ lệ oxygen và carbon monoxide hoà tan trong máu giống với tỉ lệ của chúng trong không khí. Cho biết tỉ lệ HbCO so với HbO, trong máu là bao nhiêu. Em có nhận xét gì về tính độc của khí CO?
Phương pháp giải:
Dựa vào biểu thức tính Kc phản ứng để tính tỉ lệ \(\frac{{HbCO}}{{Hb{O_2}}}\)
Lời giải chi tiết:
\({K_c} = \frac{{{\rm{[}}HbCO]{\rm{[}}{O_2}]}}{{{\rm{[}}Hb{O_2}]{\rm{[CO]}}}} \to \frac{{{\rm{[}}HbCO]}}{{{\rm{[}}Hb{O_2}]}} = {K_c}.\frac{{{\rm{[}}CO]}}{{{\rm{[}}{O_2}]}}\) = 170. 0,1:20 = 0,85
Nhận xét: chỉ 1 lượng nhỏ khí CO cũng làm giảm đáng kể khả năng vận chuyển O2 của máu.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 1. Mở đầu về cân bằng hóa học trang 3, 4, 5, 6 SBT Hóa 11 Cánh diều timdapan.com"







