Bài 1. Khái niệm về cân bằng hóa học trang 5, 6, 7, 8, 9 SBT Hóa 11 Kết nối tri thức
Phản ứng nào sau đây là phản ứng thuận nghịch?
1.1
Phản ứng nào sau đây là phản ứng thuận nghịch?
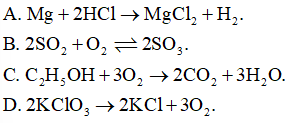
Phương pháp giải:
Trong cùng điều kiện xác định, phản ứng xảy ra theo hai chiều trái ngược nhau được gọi là phản ứng thuận nghịch. Trong phương trình hóa học của phản ứng thuận nghịch, người ta dùng kí hiệu hai mũi tên ngược chiều (\[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \]): chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch.
Lời giải chi tiết:
\[{\rm{2S}}{{\rm{O}}_2} + {{\rm{O}}_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{S}}{{\rm{O}}_3}\]là phản ứng thuận nghịch.
Các phản ứng còn lại là phản ứng một chiều.
→ Chọn B.
1.2
Cho 5 mol H2 và 5 mol I2 vào bình kín dung tích 1 lít và nung nóng đến 227 °C . Đồ thị biểu diễn sự thay đổi nồng độ các chất theo thời gian được cho trong hình sau:
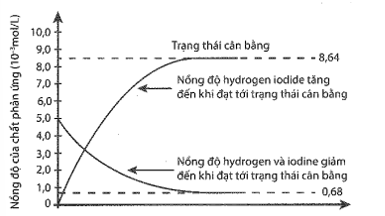
Nồng độ của HI ở trạng thái cân bằng là
A. 0,68 M. B. 5,00 M. C.3,38 M. D. 8,64 M.
Phương pháp giải:
Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Lời giải chi tiết:
\[{{\rm{H}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{I}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{HI}}\left( g \right)\]
Đường độ thị hướng lên biểu diễn nồng độ của HI, ở trạng thái cân bằng, nồng độ của HI không thay đổi.
Ta có: [HI] = 8,64 (M)
→ Chọn D.
1.3
Cho phản ứng hoá học sau: \[{\rm{B}}{{\rm{r}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{HBr}}\left( g \right)\]
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
\[{\rm{A}}.{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{2[{\rm{HBr]}}}}{{{\rm{[B}}{{\rm{r}}_2}][{{\rm{H}}_{\rm{2}}}]}}.\] \[{\rm{B}}.{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{{[{\rm{HBr]}}}^2}}}{{{\rm{[B}}{{\rm{r}}_2}][{{\rm{H}}_{\rm{2}}}]}}.\] \[{\rm{C}}.{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{\rm{[B}}{{\rm{r}}_2}][{{\rm{H}}_{\rm{2}}}]}}{{{{[{\rm{HBr]}}}^2}}}.\] \[{\rm{D}}.{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{\rm{[B}}{{\rm{r}}_2}][{{\rm{H}}_{\rm{2}}}]}}{{2[{\rm{HBr]}}}}.\]
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
\[{\rm{B}}{{\rm{r}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{HBr}}\left( g \right)\]
\[ \Rightarrow {{\rm{K}}_{\rm{C}}} = \frac{{{{[{\rm{HBr]}}}^2}}}{{{\rm{[B}}{{\rm{r}}_2}][{{\rm{H}}_{\rm{2}}}]}}\]
→ Chọn B.
1.4
Cho phản ứng hoá học sau: \[{\rm{PC}}{{\rm{l}}_3}\left( g \right) + {\rm{C}}{{\rm{l}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{PC}}{{\rm{l}}_5}\left( g \right)\]
Ở T °C, nồng độ các chất ở trạng thái cân bằng như sau: [PCl5]= 0,059 mol; [PCl3] = [Cl2] = 0,035 mol/L.
Hằng số cân bằng (Kc) của phản ứng tại T oC là
A. 1,68. B. 48,16. C. 0,02. D. 16,95.
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
\[\begin{array}{l}{\rm{PC}}{{\rm{l}}_3}\left( g \right) + {\rm{C}}{{\rm{l}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{PC}}{{\rm{l}}_5}\left( g \right){\rm{ }}\\ \Rightarrow {{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{\rm{PC}}{{\rm{l}}_{\rm{5}}}} \right]}}{{\left[ {{\rm{PC}}{{\rm{l}}_{\rm{3}}}} \right]\left[ {{\rm{C}}{{\rm{l}}_{\rm{2}}}} \right]}} = \frac{{0,059}}{{0,035 \times 0,035}} \approx 48,16\end{array}\]
→ Chọn B.
1.5
Cho phản ứng hoá học sau: \[{{\rm{N}}_2}\left( g \right){\rm{ }} + {\rm{ }}3{{\rm{H}}_{\rm{2}}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{N}}{{\rm{H}}_3}\left( g \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92{\rm{ kJ}}\]
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Thêm chất xúc tác. B. Giảm nồng độ N2 hoặc H2.
C. Tăng áp suất. D. Tăng nhiệt độ.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Chất xúc tác không làm chuyển dịch cân bằng.
Lời giải chi tiết:
|
Tác động |
Chiều chuyển dịch |
Giải thích |
|
Thêm chất xúc tác |
Không chuyển dịch |
Chất xúc tác không làm chuyển dịch cân bằng. |
|
Giảm nồng độ N2 hoặc H2 |
Nghịch (trái) |
Khi giảm nồng độ của N2 hoặc H2, cân bằng chuyển dịch theo chiều làm tăng nồng độ N2 hoặc H2. |
|
Tăng áp suất |
Thuận (phải) |
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (giảm số mol khí). |
|
Tăng nhiệt độ |
Nghịch (trái) |
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ (chiều thu nhiệt). |
→ Chọn C.
1.6
Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất?
\[\begin{array}{*{20}{l}}{{\rm{A}}.{\rm{ }}2{\rm{S}}{{\rm{O}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{S}}{{\rm{O}}_3}\left( g \right)}\\{{\rm{B}}.{\rm{ C}}\left( s \right){\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{CO}}\left( g \right) + {{\rm{H}}_2}\left( g \right)}\\{{\rm{C}}.{\rm{ PC}}{{\rm{l}}_{\rm{3}}}\left( g \right){\rm{ }} + {\rm{ C}}{{\rm{l}}_{\rm{2}}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{PC}}{{\rm{l}}_5}\left( g \right)}\\{{\rm{D}}.{\rm{ }}3{\rm{Fe}}\left( s \right) + {\rm{ }}4{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{F}}{{\rm{e}}_{\rm{3}}}{{\rm{O}}_{\rm{4}}}\left( s \right){\rm{ }} + {\rm{ }}4{{\rm{H}}_{\rm{2}}}\left( g \right)}\end{array}\]
Phương pháp giải:
Khi hệ đang ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ, cân bằng chuyển dịch theo chiều làm giảm hoặc tăng áp suất của hệ.
Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau hoặc trong hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển dịch cân bằng của hệ.
Lời giải chi tiết:
- Các phương trình ở đáp án A, B và C, đều có tổng số mol khí hai vế khác nhau, do đó các cân bằng này bị dịch chuyển khi thay đổi áp suất.
- Phương trình ở đáp án D có số mol khí ở hai vế bằng nhau (đều là 4 mol), do đó cân bằng này bị dịch chuyển khi thay đổi áp suất.
→ Chọn D.
1.7
Cân bằng hoá học sau: \[{\rm{4N}}{{\rm{H}}_{\rm{3}}}\left( g \right){\rm{ }} + {\rm{ 5}}{{\rm{O}}_{\rm{2}}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{4NO}}\left( g \right) + 6{{\rm{H}}_2}{\rm{O}}\left( g \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 905{\rm{ kJ}}\]
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Giảm nhiệt độ. B. Tăng áp suất.
C. Giảm nồng độ của O2. D. Thêm xúc tác Pt.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Chất xúc tác không làm chuyển dịch cân bằng.
Lời giải chi tiết:
|
Tác động |
Chiều chuyển dịch |
Giải thích |
|
Giảm nhiệt độ |
Thuận (phải) |
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều tỏa nhiệt). |
|
Tăng áp suất |
Nghịch (trái) |
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (giảm số mol khí). |
|
Giảm nồng độ của O2 |
Nghịch (trái) |
Khi giảm nồng độ của O2, cân bằng chuyển dịch theo chiều làm tăng nồng độ khí O2. |
|
Thêm xúc tác Pt |
Không chuyển dịch |
Chất xúc tác không làm chuyển dịch cân bằng. |
→ Chọn A.
1.8
Cho phản ứng hoá học sau: \[{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{N}}{{\rm{O}}_2}\left( g \right){\rm{ }}{{\rm{K}}_{\rm{C}}} = {\rm{ }}4,{84.10^{ - 3}}\]
Phương án nào sau đây là nồng độ của các chất tại thời điểm cân bằng?
A. [N2O4(g)] = 4,84.10-1M; [NO2(g)] = 1,0.10-4 M.
B. [N2O4(g)] = 1,0.10-1 M; [NO2(g)] = 4,84.10-4 M.
C. [N2O4(g)] = 1,0.10-1M; [NO2(g)] = 2,20.10-2 M.
D. [N2O4(g)] = 5,0.10-2M; [NO2 (g)] = 1,10.10-2 M.
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
\[{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{N}}{{\rm{O}}_2}\left( g \right){\rm{ }}{{\rm{K}}_{\rm{C}}} = {\rm{ }}4,{84.10^{ - 3}}\]
- Với [N2O4(g)] = 4,84.10-1M; [NO2(g)] = 1,0.10-4 M,\[{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_2}} \right]}^2}}}{{\left[ {{{\rm{N}}_{\rm{2}}}{{\rm{O}}_4}} \right]}} \approx 2,{07.10^{ - 8}}\]
- Với [N2O4(g)] = 1,0.10-1 M; [NO2(g)] = 4,84.10-4 M,\[{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_2}} \right]}^2}}}{{\left[ {{{\rm{N}}_{\rm{2}}}{{\rm{O}}_4}} \right]}} \approx 2,{34.10^{ - 6}}\]
- Với [N2O4(g)] = 1,0.10-1M; [NO2(g)] = 2,20.10-2 M,\[{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_2}} \right]}^2}}}{{\left[ {{{\rm{N}}_{\rm{2}}}{{\rm{O}}_4}} \right]}} = 4,{84.10^{ - 3}}\]
- Với [N2O4(g)] = 5,0.10-2M; [NO2 (g)] = 1,10.10-2 M,\[{\rm{ }}{{\rm{K}}_{\rm{C}}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_2}} \right]}^2}}}{{\left[ {{{\rm{N}}_{\rm{2}}}{{\rm{O}}_4}} \right]}} = 2,{42.10^{ - 3}}\]
Để \[{{\rm{K}}_{\rm{C}}} = {\rm{ }}4,{84.10^{ - 3}}\]thì [N2O4(g)] = 1,0.10-1M; [NO2(g)] = 2,20.10-2 M.
→ Chọn C.
1.9
Cho các phản ứng hoá học sau:
a) Các phản ứng toả nhiệt là
A. (1); (2) và (3). B. (1) và (3).
C. (1); (2); (4) và (5). D. (1); (2); (3) và (5).
b) Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (2) và (5). C. (4) và (5). D. (3) và (5).
c) Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (3) và (5). C. (2); (3) và (4). D. (3); (4) và (5).
Phương pháp giải:
a) Phản ứng tỏa nhiệt có \[{\Delta _{\rm{r}}}{\rm{H}}_{298}^0\]< 0.
b) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ (chiều thu nhiệt).
c) Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (giảm số mol khí).
Lời giải chi tiết:
a) Các phản ứng toả nhiệt (\[{\Delta _{\rm{r}}}{\rm{H}}_{298}^0\]< 0) là (1); (2) và (3).
→ Chọn A.
b) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ (chiều thu nhiệt), do đó các cân bằng (1), (2) và (3) chuyển dịch theo chiều nghịch, cân bằng (4) và (5) chuyển dịch theo chiều thuận.
→ Chọn C.
c) Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (giảm số mol khí):
- Các cân bằng chuyển dịch theo chiều thuận là (1), (2), (3).
- Cân bằng chuyển dịch theo chiều thuận là (5).
- Cân bằng không chuyển dịch là (4).
→ Chọn A.
1.10
Các kết quả trong bảng sau đây được ghi lại từ hai thí nghiệm giữa khí sulfur dioxide và khí oxygen để tạo thành khí sulfur trioxide ở 600 °C. Tính giá trị KC ở hai thí nghiệm và nhận xét kết quả thu được.
|
|
Nồng độ các chất ở thời điểm ban đầu (mol/L) |
Nồng độ các chất ở thời điểm cân bằng (mol/L) |
||||
|
SO2 |
O2 |
SO3 |
SO2 |
O2 |
SO3 |
|
|
Thí nghiệm 1 |
2,000 |
1,500 |
3,000 |
1,500 |
1,250 |
3500 |
|
Thí nghiệm 2 |
0,500 |
0 |
0,350 |
0,590 |
0,045 |
0,260 |
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
\[\begin{array}{l}2{\rm{S}}{{\rm{O}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{S}}{{\rm{O}}_3}\left( g \right)\\ \Rightarrow {{\rm{K}}_{\rm{C}}} = \frac{{{{[{\rm{S}}{{\rm{O}}_3}]}^2}}}{{{{[{\rm{S}}{{\rm{O}}_3}]}^2}.[{{\rm{O}}_2}]}}\end{array}\]
Ở thí nghiệm (1), \[{{\rm{K}}_{{\rm{C (1)}}}} = \frac{{3,{5^2}}}{{1,{5^2}.1,25}} \approx 4,356\]
Ở thí nghiệm (2), \[{{\rm{K}}_{{\rm{C (2)}}}} = \frac{{0,{{26}^2}}}{{0,{{59}^2}.0,045}} \approx 4,315\]
Nhận xét: Mặc dù nồng độ các chất tại thời điểm cân bằng ở hai thí nghiệm khác nhau nhưng giá trị KC ở hai thí nghiệm gần bằng nhau.
1.11
Polystyrene là một loại nhựa thông dụng được dùng để làm đường ống nước. Nguyên liệu để sản xuất polystyrene là styrene (C6H5CH=CH2). Styrene được điều chế từ phản ứng sau:
\[{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{H}}_{\rm{3}}}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{CH = C}}{{\rm{H}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{H}}_2}\left( g \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = 123{\rm{ kJ}}\]
Cân bằng hoá học của phản ứng trên sẽ chuyển dịch theo chiều nào nếu:
a) Tăng áp suất của bình phản ứng.
b) Tăng nhiệt độ của phản ứng.
c) Tăng nồng độ của C6H5CH2CH3.
d) Thêm chất xúc tác.
e) Tách styrene ra khỏi bình phản ứng.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Chất xúc tác không làm chuyển dịch cân bằng.
Lời giải chi tiết:
a) Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (giảm số mol khí), cân bằng chuyển dịch theo chiều nghịch.
b) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ (chiều thu nhiệt), cân bằng chuyển dịch theo chiều thuận.
c) Khi tăng nồng độ của C6H5CH2CH3, cân bằng chuyển dịch theo chiều giảm nồng độ của C6H5CH2CH3, cân bằng chuyển dịch theo chiều thuận.
d) Chất xúc tác chỉ làm tăng tốc độ của phản ứng thuận và phản ứng nghịch, giúp phản ứng nhanh đạt trạng thái cân bằng. Do đó chất xúc tác không làm chuyển dịch cân bằng.
e) Khi tách styrene ra khỏi bình phản ứng, nồng độ styrene trong phản ứng giảm, cân bằng chuyển dịch theo chiều tăng nồng độ của styrene, cân bằng chuyển dịch theo chiều thuận.
1.12
Phosphorus trichloride (PCl3) phản ứng với chlorine (Cl2) tạo thành phosphorus pentachloride (PCl5) theo phản ứng: \[{\rm{PC}}{{\rm{l}}_{\rm{3}}}\left( g \right){\rm{ }} + {\rm{ C}}{{\rm{l}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{PC}}{{\rm{l}}_{\rm{5}}}\left( g \right)\]
Cho 0,75 mol PCl3 và 0,75 mol Cl2 vào bình kín dung tích 8 lít ở 227 °C. Tính nồng độ các chất ở trạng thái cân bằng, biết giá trị hằng số cân bằng Kc ở 227 oC là 49.
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
\[{\rm{PC}}{{\rm{l}}_{\rm{3}}}\left( g \right){\rm{ }} + {\rm{ C}}{{\rm{l}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ PC}}{{\rm{l}}_{\rm{5}}}\left( g \right)\]
Ban đầu (mol): 0,75 0,75 0
Phản ứng (mol): x → x → x
Cân bằng (mol): 0,75 - x 0,75 - x x
\[ \Rightarrow {\rm{[PC}}{{\rm{l}}_{\rm{3}}}{\rm{] = [C}}{{\rm{l}}_{\rm{2}}}{\rm{] = }}\frac{{0,75 - x}}{8}{\rm{ (M); [PC}}{{\rm{l}}_{\rm{5}}}{\rm{] = }}\frac{{\rm{x}}}{{\rm{8}}}{\rm{ (M)}}\]
\[\begin{array}{l} \Rightarrow {{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{\rm{[PC}}{{\rm{l}}_{\rm{5}}}{\rm{] }}}}{{{\rm{[PC}}{{\rm{l}}_{\rm{3}}}{\rm{]}}{\rm{.[C}}{{\rm{l}}_{\rm{2}}}{\rm{]}}}} = \frac{{\frac{{\rm{x}}}{{\rm{8}}}}}{{{{\left( {\frac{{0,75 - x}}{8}} \right)}^2}{\rm{ }}}} = 49\\ \Rightarrow {\rm{x}} \approx 0,472{\rm{ (mol)}}\\ \Rightarrow {\rm{[PC}}{{\rm{l}}_{\rm{3}}}{\rm{] = [C}}{{\rm{l}}_{\rm{2}}}{\rm{] = }}\frac{{0,75 - 0,472}}{8}{\rm{ = 0,03475 (M); [PC}}{{\rm{l}}_{\rm{5}}}{\rm{] = }}\frac{{{\rm{0,472}}}}{{\rm{8}}}{\rm{ = 0,059 (M)}}\end{array}\]
1.13
Trong một bình kín xảy ra cân bằng hoá học sau:
\[{{\rm{H}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{I}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{HI}}\left( g \right)\]
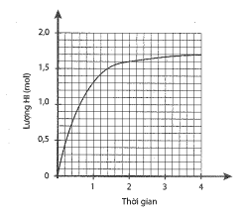
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.
Phương pháp giải:
a) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
b) Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trìn
a) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
b) Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
c) Tính hiệu suất dựa vào H2 hoặc I2.
h hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
c) Tính hiệu suất dựa vào H2 hoặc I2.
Lời giải chi tiết:
a) Ta có: \[{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}} = {{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}} = \frac{1}{2} = 0,5{\rm{ }}({\rm{M}})\];
Dựa vào đồ thị, ta thấy tại thời điểm cân bằng: \[{{\rm{n}}_{{\rm{HI}}}} = 1,7{\rm{ }}({\rm{mol}}) \Rightarrow [{\rm{HI}}] = \frac{{1,7}}{2} = 0,85{\rm{ }}({\rm{M}})\]
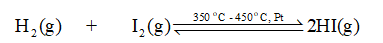
Ban đầu (M): 0,5 0,5 0
Phản ứng (M): 0,425 ← 0,425 ← 0,85
Cân bằng (M): 0,075 0,075 0,85
Vậy \[{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{] = [}}{{\rm{I}}_{\rm{2}}}{\rm{] = 0,5}} - 0,425 = 0,075{\rm{ (M); [HI] = 0,85 (M)}}\]
b) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[HI]}}}^{\rm{2}}}}}{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{][}}{{\rm{I}}_{\rm{2}}}{\rm{]}}}} = \frac{{0,{{85}^2}}}{{0,075 \times 0,075}} \approx 128,444\]
c) Ta có: \[{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}{\rm{ bdau}}}} = 0,5{\rm{ }}({\rm{M}});{\rm{ }}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}{\rm{ p/u}}}} = 0,425{\rm{ }}({\rm{M}})\]
\[ \Rightarrow {\rm{H}} = \frac{{0,425}}{{0,5}} \times 100\% = 85\% \]
1.14
Khi xăng cháy trong động cơ ô tô sẽ tạo ra nhiệt độ cao, lúc đó N2 phản ứng với O2 tạo thành NO:
\[{{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\left( g \right){\rm{ }}\left( 1 \right)\]
NO khi được giải phóng ra không khí nhanh chóng kết hợp với O2 tạo thành NO2 là một khí gây ô nhiễm môi trường. Ở 2 000 °C, hằng số cân bằng KC của phản ứng (1) là 0,01.
Nếu trong bình kín dung tích 1 lít có 4 mol N2 và 0,1mol O2 thì ở 2 000 °C lượng khí NO tạo thành là bao nhiêu (giả thiết NO chưa phản ứng với O2)?
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \[ \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \] cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Lời giải chi tiết:
Ta có: \[{{\rm{C}}_{{{\rm{N}}_{\rm{2}}}}} = \frac{4}{1}{\rm{ = 4 (M); }}{{\rm{C}}_{{{\rm{O}}_{\rm{2}}}}} = \frac{{0,1}}{1} = 0,1{\rm{ }}({\rm{M}})\];
\[{{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{NO}}\left( g \right){\rm{ }}\left( 1 \right)\]
Ban đầu (M): 4 0,1 0
Phản ứng (M): 0,5x ← 0,5x ← x
Cân bằng (M): 4 - 0,5x 0,1 – 0,5x x
Ở 2 000 °C, ta có: KC = 0,01
\[\begin{array}{l} \Leftrightarrow \frac{{{{{\rm{[NO]}}}^{\rm{2}}}}}{{{\rm{[}}{{\rm{N}}_{\rm{2}}}{\rm{][}}{{\rm{O}}_2}{\rm{]}}}} = 0,01\\ \Leftrightarrow \frac{{{{\rm{x}}^2}}}{{(4 - 0,5{\rm{x}})(0,1 - 0,5{\rm{x}})}} = 0,01\\ \Rightarrow {\rm{x}} \approx 0,0{\rm{54 (M)}}\end{array}\]
\[ \Rightarrow \]Lượng khí NO tạo thành là: \[{{\rm{n}}_{{\rm{NO}}}} = 0,054 \times 1 = 0,054{\rm{ (mol)}}\]
1.15
Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:
\[{\left[ {{\rm{Co}}{{\left( {{{\rm{H}}_{\rm{2}}}{\rm{O}}} \right)}_6}} \right]^{2 + }} + {\rm{ }}4{\rm{C}}{{\rm{l}}^ - } \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\left[ {{\rm{CoC}}{{\rm{l}}_{\rm{4}}}} \right]^{2 - }} + {\rm{ }}6{{\rm{H}}_{\rm{2}}}{\rm{O }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 > 0\]
màu hồng màu xanh
Dự đoán sự biến đổi màu sắc của ống nghiệm đựng dung dịch CoCl2 trong các trường hợp sau:
a) Thêm từ từ HCl đặc.
b) Ngâm ống nghiệm vào cốc nước nóng.
c) Thêm một vài giọt dung dịch AgNO3.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Lời giải chi tiết:
a) Khi thêm từ từ HCl đặc, nồng độ ion \[{\rm{C}}{{\rm{l}}^ - }\]tăng, cân bằng chuyển dịch theo chiều làm giảm nồng độ ion \[{\rm{C}}{{\rm{l}}^ - }\], cân bằng chuyển dịch theo chiều thuận, làm dung dịch chuyển sang màu xanh.
b) Khi ngâm ống nghiệm vào cốc nước nóng, làm nhiệt độ của hệ phản ứng tăng, cân bằng chuyển dịch theo chiều giảm nhiệt độ (chiều thu nhiệt), cân bằng chuyển dịch theo chiều thuận, làm dung dịch chuyển sang màu xanh.
c) Khi thêm một vài giọt dung dịch AgNO3, nồng độ ion \[{\rm{C}}{{\rm{l}}^ - }\]giảm vì xảy ra phản ứng: \[{\rm{A}}{{\rm{g}}^ + } + {\rm{C}}{{\rm{l}}^ - } \to {\rm{AgCl}} \downarrow \]. Lúc này cân bằng chuyển dịch theo chiều làm tăng nồng độ ion \[{\rm{C}}{{\rm{l}}^ - }\], cân bằng chuyển dịch theo chiều nghịch, làm dung dịch chuyển sang màu hồng.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 1. Khái niệm về cân bằng hóa học trang 5, 6, 7, 8, 9 SBT Hóa 11 Kết nối tri thức timdapan.com"







