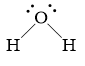
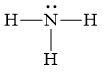
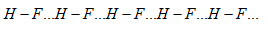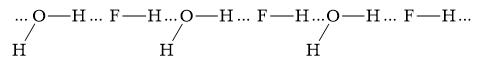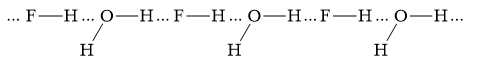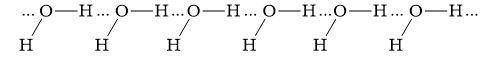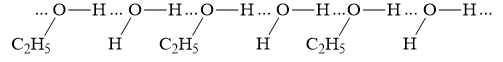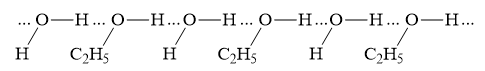Bài 13. Liên kết hydrogen và tương tác van der waals trang 34, 35 SBT Hóa 10 Kết nối tri thức với cuộc sống
Liên kết hydrogen là loại liên kết hoá học được hình thành giữa các nguyên tử nào sau đây? Tương tác van der Waals được hình thành do
13.1
Liên kết hydrogen là loại liên kết hoá học được hình thành giữa các nguyên tử nào sau đây?
A. Phi kim và hydrogen trong hai phân tử khác nhau.
B. Phi kim và hydrogen trong cùng một phân tử.
C. Phi kim có độ âm điện lớn và nguyên tử hydrogen.
D. F, O, N,... có độ âm điện lớn, đồng thời có cặp electron hoá trị chưa liên kết và nguyên tử hydrogen linh động.
Phương pháp giải:
Dựa vào
- Định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
- Đáp án: D
13.2
Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
Phương pháp giải:
Dựa vào
- Định nghĩa của tương tác van der Waals: là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng
Lời giải chi tiết:
- Đáp án: C
13.3
Chất nào sau đây có thể tạo liên kết hydrogen?
A. PF3. B. CH4. C. CH3OH D. H2S.
Phương pháp giải:
Dựa vào
- Định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
- Đáp án: C
- Giải thích: Trong 4 đáp án trên, chỉ có đáp án C thỏa mãn điều kiện để tạo liên kết hydrogen: Có nguyên tử H (đã liên kết với nguyên tố có độ âm điện cao là O) liên kết với một nguyên tử khác có độ âm điện lớn là O (của phân tử CH3OH)
13.4
Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O. B. CH4. C. CH3OH. D. NH3.
Phương pháp giải:
Dựa vào
- Định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
- Đáp án: B
- Giải thích: Trong 4 đáp án trên, CH4 không thỏa mãn điều kiện để tạo liên kết hydrogen: Do nguyên tử H chỉ liên kết với C (nguyên tố không có độ âm điện cao)
13.5
Tương tác van der Waals tồn tại giữa những
A. ion. B. hạt proton. C. hạt neutron. D. phân tử.
Phương pháp giải:
Dựa vào
- Định nghĩa của tương tác van der Waals: là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng
Lời giải chi tiết:
- Đáp án: D
13.6
Cho các chất sau: F2, Cl2, Br2, I2. Chất có nhiệt độ nóng chảy thấp nhất là
A. F2. B. Cl2. C. Br2. D. I2.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Đáp án: A
- Giải thích: Phân tử khối của F2 nhỏ nhất trong các chất trên
13.7
Cho các chất sau F2, Cl2, Br2, I2. Chất có nhiệt độ sôi cao nhất là
A. F2. B. Cl2. C. Br2. D. I2.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Đáp án: D
- Giải thích: Phân tử khối của I2 lớn nhất trong các chất trên
13.8
Dãy chất nào sau đây xếp theo thứ tự nhiệt độ sôi tăng dần?
A. H2O, H2S, CH4.
B. H2S, CH4, H2O.
C. CH4, H2O, H2S.
D. CH4, H2S, H2O.
Phương pháp giải:
Dựa vào ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ sôi và nhiệt độ nóng chảy của các chất
- Các chất có liên kết hydrogen đều có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các chất không có liên kết hydrogen
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Phân tử H2O có liên kết hydrogen " nhiệt độ sôi cao nhất
- Có " nhiệt độ sôi của H2S cao hơn nhiệt độ sôi của CH4
=> Đáp án: D
13.9
Cho các khí hiểm sau: He, Ne, Ar, Kr, Xe. Khí hiếm có nhiệt độ nóng chảy thấp nhất và cao nhất lần lượt là
A. Xe và He.
B. Ar và Ne.
C. He và Xe.
D. He vȧ Kr.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Đáp án: C
- Giải thích: Phân tử khối của He nhỏ nhất trong các chất trên và phân tử khối của Xe lớn nhất trong các chất trên
13.10
Cho các chất sau: C2H6; H2O; NH3; PF3; C2H5OH. Số chất tạo được liên kết hydrogen là
A. 2. B. 3. C. 4. D. 5.
Phương pháp giải:
Dựa vào
- Định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
- Đáp án: B
- Giải thích: Các phân tử tạo được liên kết hydrogen là H2O; NH3; C2H5OH
3.11
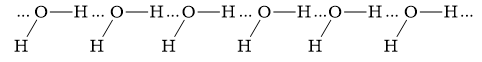
Giữa H2O và HF có thể tạo ra ít nhất bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 3. C. 4. D. 5.
Phương pháp giải:
Dựa vào
- Phân loại liên kết hydrogen:
+ Liên kết hydrogen nội phân tử: là liên kết hydrogen được tạo thành trong chính phân tử chất đó
Điều kiện để có liên kết hydrogen nội phân tử:
· Hợp chất phải chứa từ 2 nhóm chức trở lên
· Khi tạo thành liên kết hydrogen phải tạo được vòng 5 hoặc 6 cạnh
+ Liên kết hydrogen liên phân tử: là liên kết hydrogen được tạo thành giữa phân tử này và phân tử khác
Lời giải chi tiết:
H2O và HF có thể tạo ra 4 loại liên kết hydrogen
1. Liên kết giữa 2 phân tử H2O:
2. Liên kết giữa 2 phân tử HF:
3. Liên kết giữa phân tử H2O và HF:
4. Liên kết giữa phân tử HF và H2O:
=>Đáp án: C
13.12
Nhiệt độ sôi của từng chất methane, ethane, propane và butane là một trong bốn nhiệt độ sau: 0 °C; -164 °C; -42 °C và -88 °C. Nhiệt độ sôi -88 °C là của chất nào sau đây
A. methane.
B. propane.
C. ethane.
D. butane.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Thứ tự tăng dần phân tử khối: methane < ethane < propane < butane
" Thứ tự tăng dần nhiệt độ sôi: -164 °C < -88 °C < -42 °C < 0 °C
=> Đáp án: C
13.13
Cho các chất sau: C2H6, CH3OH, CH3COOH. Chất nào có thể tạo được liên kết hydrogen? Vì sao?
Phương pháp giải:
Dựa vào
- Định nghĩa liên kết hydrogen: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết
Lời giải chi tiết:
- Trong các chất trên, CH3OH và CH3COOH thỏa mãn điều kiện để tạo liên kết hydrogen: Có nguyên tử H (đã liên kết với nguyên tố có độ âm điện cao là O) liên kết với một nguyên tử khác có độ âm điện lớn là O (của phân tử CH3OH hoặc của phân tử CH3COOH)
14.14
Khối lượng mol (g/mol) của nước, ammonia và methane lần lượt bằng 18, 17 và 16. Nước sôi ở 100 °C, còn ammonia sôi ở -33,35 °C và methane sôi ở -161,58 °C. Giải thích vì sao các chất trên có khối lượng mol xấp xỉ nhau nhưng nhiệt độ sôi của chúng lại chênh lệch nhau.
Phương pháp giải:
Dựa vào ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ sôi và nhiệt độ nóng chảy của các chất
- Các chất có liên kết hydrogen đều có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các chất không có liên kết hydrogen
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Phân tử H2O và NH3 có liên kết hydrogen nên nhiệt độ sôi cao hơn phân tử CH4 (CH4 không có)
- Độ âm điện của oxygen > độ âm điện của nitrogen " nhiệt độ sôi của H2O cao hơn nhiệt độ sôi của NH3
13.15
Trong dung dịch ethanol (C2H5OH) có những kiểu liên kết hydrogen nào? Kiểu nào bền nhất và kém bền nhất? Mô tả bằng hình vẽ.
Phương pháp giải:
Dựa vào
- Phân loại liên kết hydrogen:
+ Liên kết hydrogen nội phân tử: là liên kết hydrogen được tạo thành trong chính phân tử chất đó
Điều kiện để có liên kết hydrogen nội phân tử:
· Hợp chất phải chứa từ 2 nhóm chức trở lên
· Khi tạo thành liên kết hydrogen phải tạo được vòng 5 hoặc 6 cạnh
+ Liên kết hydrogen liên phân tử: là liên kết hydrogen được tạo thành giữa phân tử này và phân tử khác
Lời giải chi tiết:
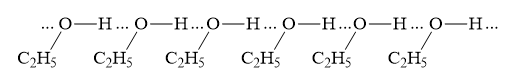
Trong dung dịch C2H5OH có H2O " C2H5OH và H2O có thể tạo ra 4 loại liên kết hydrogen
1. Liên kết giữa 2 phân tử H2O:
2. Liên kết giữa 2 phân tử C2H5OH:
3. Liên kết giữa phân tử C2H5OH và H2O:
4. Liên kết giữa phân tử H2O và C2H5OH:
- Liên kết hydrogen càng bền khi nguyên tử có độ âm điện lớn hơn và nguyên tử H linh động hơn.
- C2H5- là gốc đẩy electron làm nguyên tử oxygen trên nhóm -OH có mật độ electron cao hơn và nguyên tử hydrogen trên nhóm -OH kém linh động.
-> Liên kết hydrogen giữa H2O và C2H5OH bền nhất
-> Liên kết hydrogen giữa C2H5OH và H2O kém bền nhất
13.16
Trong phân tử nước và ammonia, phân tử nào có thể tạo nhiều liên kết hydrogen hơn? Vì sao?
Phương pháp giải:
Dựa vào: số liên kết hydrogen được hình thành trên mỗi phân tử phụ thuộc vào các yếu tố sau:
- Số nguyên tử hydrogen đã liên kết với nguyên tố có độ âm điện cao (F, O, N) trong phân tử
- Số cặp electron chưa liên kết trên nguyên tử F, O, N của phân tử khác
Lời giải chi tiết:
- Công thức Lewis của H2O:
+ Phân tử H2O có 2 nguyên tử hydrogen có thể tham gia liên kết hydrogen
+ Nguyên tử O trên H2O có 2 cặp electron chưa liên kết
=> Mỗi phân tử H2O có thể tạo ra tối đa 2 liên kết hydrogen
- Công thức Lewis của NH3:
+ Phân tử NH3 có 3 nguyên tử hydrogen có thể tham gia liên kết hydrogen
+ Nguyên tử N trên NH3 có 1 cặp electron chưa liên kết
=> Mỗi phân tử NH3 có thể tạo ra tối đa 1 liên kết hydrogen
13.17
Dầu mỏ chứa hỗn hợp nhiều hydrocarbon như: octane (C8H18) có trong xăng, butane (C4H10) có trong gas. Khi chưng cất dầu mỏ, octane hay butane sẽ bay hơi trước? Giải thích.
Phương pháp giải:
Dựa vào
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- Có \({M_{{C_8}{H_{18}}}} > {M_{{C_4}{H_{10}}}}\) => nhiệt độ sôi của C8H18 cao hơn nhiệt độ sôi của C4H10
=> butane sẽ bay hơi trước octane
13.18
Cho các chất và các trị số nhiệt độ sôi (°C) sau:
H2O, H2S, H2Se, H2Te và -42 °C; -2 °C; 100 °C; -61 °C.
Ghép các trị số nhiệt độ sôi vào mỗi chất sao cho phù hợp và giải thích.
Phương pháp giải:
Dựa vào ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ sôi và nhiệt độ nóng chảy của các chất
- Các chất có liên kết hydrogen đều có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn các chất không có liên kết hydrogen
- Đặc điểm của tương tác van der Waals:
+ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
+ Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Lời giải chi tiết:
- H2O có liên kết hydrogen => nhiệt độ sôi cao nhất
- Thứ tự sắp xếp phân tử khối của các chất còn lại theo chiều tăng dần là: H2S < H2Se < H2Te
=> Giá trị nhiệt độ sôi của từng chất như sau: H2O (100 °C), H2S (-61 °C), H2Se (-42 °C), H2Te (-2 °C)
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 13. Liên kết hydrogen và tương tác van der waals trang 34, 35 SBT Hóa 10 Kết nối tri thức với cuộc sống timdapan.com"