Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
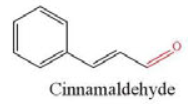
Cinnamaldehyde là hợp chất carbonyl có trong tinh dầu quế, được sử dụng làm hương liệu, dược liệu,.. Vậy hợp chất carbonyl là gì?
MĐ
Cinnamaldehyde là hợp chất carbonyl có trong tinh dầu quế, được sử dụng làm hương liệu, dược liệu,.. Vậy hợp chất carbonyl là gì?
Phương pháp giải:
Nhóm  trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl. Aldehyde, ketone thuộc loại hợp chất carbonyl.
trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl. Aldehyde, ketone thuộc loại hợp chất carbonyl.
Lời giải chi tiết:
Hợp chất carbonyl là các hợp chất hữu cơ trong phân tử có chứa nhóm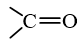 (carbonyl). Aldehyde, ketone thuộc loại hợp chất carbonyl.
(carbonyl). Aldehyde, ketone thuộc loại hợp chất carbonyl.
LT 1
Cho các hợp chất có công thức sau:
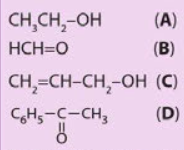
Trong các hợp chất trên, hợp chất nào là hợp chất carbonyl, hợp chất nào thuộc loại aldehyde, ketone?
Phương pháp giải:
Nhóm  trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl.
trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl.
Aldehyde là hợp chất hữu cơ trong phân tử có nhóm -CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
Ketone là hợp chất hữu cơ có nhóm carbonyl liên kết với hai gốc hydrocarbon.
Lời giải chi tiết:
(B) và (D) là hợp chất carbonyl. Trong đó (B) là aldehyde, (D) là ketone.
CH 1
Hãy mô tả hình dạng phân tử methanal và ethanal.
Phương pháp giải:
Quan sát mô hình phân tử của methanal và ethanal, nêu ra hình dạng và các liên kết có trong các phân tử.
Lời giải chi tiết:
Phân tử methanal gồm 1 nguyên tử carbon liên kết với 1 nguyên tử oxygen và 2 nguyên tử hydrogen, các nguyên tử đều nằm trên một mặt phẳng.
Phân tử ethanal có 2 nguyên tử carbon liên kết với nhau, trong đó 1 nguyên tử carbon nằm ở tâm một hình tứ diện liên kết với 3 nguyên tử hydrogen, nguyên tử carbon còn lại liên kết với 1 nguyên tử oxygen và 1 nguyên tử hydrogen.
Hai phân tử trên có nhóm carbonyl, gồm nguyên tử carbon liên kết với nguyên tử oxygen bằng 1 liên kết σ bền và 1 liên kết π kém bền. Liên kết đôi C=O và 2 liên kết đơn nằm trên 1 mặt phẳng, góc liên kết khoảng 120°. Liên kết đôi C=O phân cực về phía nguyên tử oxygen.
LT 2
Viết công thức cấu tạo và gọi tên thay thế, tên thông thường (nếu có) các hợp chất carbonyl có cùng công thức C4H8O.
Phương pháp giải:
- Viết công thức cấu tạo của ketone và aldehyde no, đơn, hở có công thức C4H8O.
- Danh pháp:
+ Tên thay thế:

+ Tên thông thường:
Tên thông thường của aldehyde: Các aldehyde mà acid tương ứng của chúng có tên thông thường thì có thể được gọi tên thông thường bằng cách thay “ic acid" bằng "...ic aldehyde” hoặc “... aldehyde”.
Lời giải chi tiết:
- Aldehyde no, đơn, hở có công thức C4H8O:

- Ketone no, đơn, hở có công thức C4H8O:

CH 2
Dựa vào đặc điểm cấu tạo của hợp chất carbonyl, giải thích vì sao các aldehyde đơn giản như formic aldehyde và acetic aldehyde lại là các chất khí ở nhiệt độ thường.
Phương pháp giải:
Tương tác Van der Waals, liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của chất.
Lời giải chi tiết:
Lực tương tác giữa các phân tử formic aldehyde và acetic aldehyde nhỏ vì:
+ Formic aldehyde và acetic aldehyde có phân tử khối nhỏ, tương tác Van der Waals giữa các phân tử nhỏ.
+ Không có liên kết hydrogen giữa các phân tử với nhau.
Do lực tương tác giữa các phân tử formic aldehyde hay acetic aldehyde nhỏ, nên formic aldehyde và acetic aldehyde là các chất khí ở điều kiện thường.
LT 3
Cho các chất có công thức sau: C2H6, C2H5OH, HCH=O, CH3CH=O, CH3CH2CH=O và các dữ liệu nhiệt độ sôi là 78,3 °C, -88,6 °C, 20,2 °C, −19,5 °C, 49 °C (không theo thứ tự). Hãy dự đoán nhiệt độ sôi tương ứng với mỗi chất trên. Giải thích.
Phương pháp giải:
So với các alcohol có cùng số nguyên tử carbon trong phân tử, các hợp chất carbonyl có nhiệt độ sôi, nhiệt độ nóng chảy thấp hơn nhiều. Các hợp chất carbonyl có nhiệt độ sôi cao hơn nhiều so với các hydrocarbon có phân tử khối tương đương.
Lời giải chi tiết:
Giải thích: + Các phân tử C2H5OH có liên kết hydrogen liên phân tử và liên kết hydrogen với nước, do đó nhiệt độ sôi của C2H5OH lớn hơn so với các chất còn lại.
+ Các aldehyde có nhiệt độ sôi cao hơn nhiều so với hydrocarbon C2H6.
+ Nhiệt sộ sôi của các aldehyde tăng theo chiều tăng của phân tử khối.
=> Nhiệt độ sôi của các chất được sắp xếp theo thứ tự giảm dần là: C2H5OH, CH3CH2CH=O, CH3CH=O, HCH=O, C2H6
CH 3
Vì sao các hợp chất carbonyl mạch ngắn như formaldehyde, acetaldehyde, acetone lại tan tốt trong nước?
Phương pháp giải:
Các hợp chất carbonyl mạch ngắn tan tốt trong nước nhờ tạo liên kết hydrogen với nước.
Lời giải chi tiết:
Các hợp chất carbonyl mạch ngắn như formaldehyde, acetaldehyde, acetone tan tốt trong nước vì các phân tử formaldehyde, acetaldehyde, acetone tạo được liên kết hydrogen với nước.
CH 4
Dựa vào giá trị độ âm điện của carbon và oxygen, nhận xét về sự phân cực của liên kết C=O trong các hợp chất carbonyl.
Phương pháp giải:
Trong liên kết giữa nguyên tử A và B, nếu độ âm điện của nguyên tử A nhỏ hơn độ âm điện của nguyên tử B thì cặp electron dùng chung sẽ bị lệch về phía nguyên tử B. Nguyên tử B lúc này mang một phần điện tích âm (δ−), nguyên tử A mang một phần điện tích dương (δ+). Liên kết này gọi là liên kết cộng hóa trị có cực.
Lời giải chi tiết:
Giá trị độ âm điện của carbon và oxygen lần lượt là 2,55 và 3,44.
Do độ âm điện của nguyên tử oxygen lớn hơn nguyên tử carbon nên cặp electron dùng chung của liên kết C=O bị lệch về phía nguyên tử oxygen. Liên kết C=O phân cực về phía nguyên tử oxygen.
CH 5
Viết sơ đồ phản ứng của các hợp chất carbonyl có công thức phân tử là C4H8O voi LiAlH4.
Phương pháp giải:
Aldehyde bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc một; ketone bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc hai.
Lời giải chi tiết:
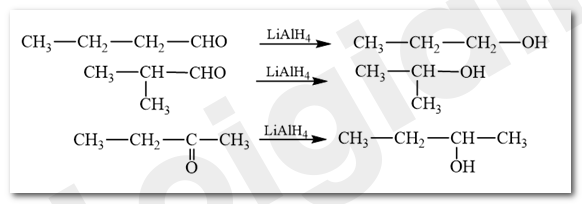
LT 4
Viết phương trình hoá học (nếu có) của phản ứng giữa propanal và propanone với:
a) Thuốc thử Tollens.
b) Cu(OH)2/OH-.
Phương pháp giải:
a) Aldehyde phản ứng với thuốc thử Tollens, tạo lớp bạc bám (phản ứng tráng bạc).
Ketone không có phản ứng với thuốc thử Tollens.
b) Trong môi trường kiềm, Cu(OH)2 oxi hoá hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch.
Ketone không có phản ứng với Cu(OH)2 (trong môi trường kiềm).
Lời giải chi tiết:
a) Propanal phản ứng với thuốc thử Tollens, propanone không phản ứng với thuốc thử Tollens.
CH3CH2CH=O + 2(Ag(NH3)2)OH CH3CH2COONH4 +2Ag + 3NH3 + H2O
b) Propanal phản ứng với Cu(OH)2/OH, propanone không phản ứng với Cu(OH)2/OH.
CH3CH2CHO + 2Cu(OH)2 + NaOH CH3CH2COONa + Cu2O+3H2O
LT 5
Hãy trình bày cách phân biệt acetaldehyde và acetone.
Phương pháp giải:
Ketone không có phản ứng với thuốc thử Tollens hoặc với Cu(OH)2 (trong môi trường kiềm) nên có thể dùng thuốc thử Tollens hoặc Cu(OH)2 để phân biệt aldehyde với ketone.
Lời giải chi tiết:
- Đánh số thứ tự cho từng dung dịch. Trích dung dịch làm mẫu thử đánh số thứ tự tương ứng.
- Cho vào 2 ống nghiệm mỗi ống khoảng 1 mL dung dịch AgNO3 1% và nhỏ từ từ từng giọt dung dịch NH3 5% và lắc nhẹ cho đến khi vừa hoà tan hết kết tủa silver oxide, thu được thuốc thử Tollens.
- Cho lần lượt từng mẫu thử (vài giọt) vào từng ống nghiệm chứa thuốc thử Tollens, lắc đều các ống nghiệm. Đun nóng nhẹ hỗn hợp trong các ống nghiệm trên ngọn lửa đèn cồn.
+ Nếu có lớp bạc trắng sáng bám thành ống nghiệm mẫu thử là acetaldehyde.
CH3CH=O + 2(Ag(NH3)2)OH CH3COONH4 +2Ag + 3NH3 + H2O
+ Không có hiện tượng mẫu thử là acetone.
TN 1
Thí nghiệm 1. Phản ứng oxi hoá aldehyde bằng thuốc thử Tollens
Chuẩn bị: Dung dịch AgNO3 1%, dung dịch NH3 5%, dung dịch CH3CHO 5%; ống nghiệm.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch AgNO3 1% và nhỏ từ từ từng giọt dung dịch NH3 5% và lắc nhẹ cho đến khi vừa hoà tan hết kết tủa silver oxide, thu được thuốc thử Tollens (thuốc thử Tollens sẽ kém nhạy nếu dư dung dich NH3). Nhỏ vài giọt dung dịch acetaldehyde 5% vào dung dịch thuốc thử Tollens, lắc đều ống nghiệm. Đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Phương pháp giải:
Aldehyde phản ứng với thuốc thử Tollens, tạo lớp bạc bám (phản ứng tráng bạc).
Phản ứng tổng quát giữa của thuốc thử Tollens với aldehyde như sau:
R-CH=O + 2(Ag(NH3)2)OH →R-COONH4 +2Ag + 3NH3 + H2O
Lời giải chi tiết:
- Khi cho dung dịch AgNO3 và dung dịch NH3 thì xuất hiện kết tủa xám silver oxide:
2AgNO3 + 2NH3 + H2O → Ag2O + 2NH4NO3
- Tiếp tục nhỏ từ từ dung dịch NH3 vào ống nghiệm, kết tủa tan:
Ag2O + H2O + 4NH3 → 2(Ag(NH3)2)OH
- Khi nhỏ vài giọt dung dịch acetaldehyde 5% vào dung dịch thuốc thử Tollens, lắc đều ống nghiệm xuất hiện lớp bạc bám trên ống nghiệm.
Lớp bạc trên ống nghiệm là Ag sinh ra từ phản ứng giữa acetaldehyde và thuốc thử Tollens:
CH3CH=O + 2(Ag(NH3)2)OH CH3COONH4 +2Ag + 3NH3 + H2O
CH 6
Vì sao trong phản ứng tráng bạc, người ta không đun sôi hỗn hợp chất phản ứng?
Phương pháp giải:
Ở nhiệt độ cao, tốc độ phản ứng tăng.
Phức bạc (Ag(NH3)2)OH dễ bị phân hủy ở nhiệt độ cao.
Lời giải chi tiết:
Nhiệt độ cao sẽ làm tăng tốc độ phản ứng quá nhanh, không kiểm soát được, quá trình tráng bạc diễn ra không đồng đều, khó tạo được lớp tráng mỏng và đồng nhất. Nhiệt độ cao làm phân hủy phức chất bạc (Ag(NH3)2)OH tạo ra trong quá trình phản ứng, ảnh hưởng đến hiệu suất kết tủa bạc.
TN 2
Thí nghiệm 2. Phản ứng oxi hoá aldehyde bằng Cu(OH)2.
Chuẩn bị: Dung dịch CuSO4 2%, dung dịch NaOH 10%, dung dịch CH3CHO 5%; ống nghiệm.
Tiến hành: Cho khoảng 1 mL dung dịch CuSO4 2% vào ống nghiệm, rồi cho tiếp khoảng 1 mL dung dịch NaOH 10%. Lắc ống nghiệm, nhỏ từ từ khoảng 1 mL dung dịch CH3CHO vào ống nghiệm. Đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Phương pháp giải:
Trong môi trường kiềm, Cu(OH)2 oxi hoá hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch.
Lời giải chi tiết:
- Cho dung dịch CuSO4 vào ống nghiệm, rồi cho tiếp dung dịch NaOH, thấy xuất hiện kết tủa xanh lam Cu(OH)2.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
- Nhỏ vào ống nghiệm trên dung dịch CH3CHO, đun nóng nhẹ hỗn hợp trong ống nghiệm trên ngọn lửa đèn cồn, thấy xuất hiện kết tủa đỏ gạch Cu2O.
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O + 3H2O
TN 3
Thí nghiệm 3. Phản ứng tạo iodoform
Chuẩn bị: Dung dịch I, trong KI, dung dịch NaOH 10%, acetaldehyde; ống nghiệm.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch I2 trong KI và khoảng 1 mL dung dịch NaOH 10%. Nhỏ từ từ 5 – 7 giọt acetaldehyde vào ống nghiệm. Lắc đều.
Yêu cầu: Quan sát hiện tượng xảy ra trong ống nghiệm và giải thích.
Phương pháp giải:
Khi cho hợp chất chứa nhóm methyl ketone (CH3CO-R) phản ứng với iodine trong môi trường kiềm tạo ra kết tủa iodoform (triiodomethane) màu vàng
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa màu vàng.
- Giải thích: acetaldehyde chứa nhóm methyl ketone phản ứng với I2 trong môi trường kiềm tạo kết tủa iodoform màu vàng.
CH3CO-H + 3I2 +4NaOH → H-COONa+ 3NaI + CHI3 + 3H2O
CH 7
Tìm hiểu và trình bày các ứng dụng của formaldehyde, acetaldehyde và acetone.
Phương pháp giải:
- Formaldehyde dùng làm dung môi, sản xuất nhựa phenol formaldehyde....
- Acetaldehyde làm nguyên liệu.
- Acetone làm dung môi, nguyên liệu.
Lời giải chi tiết:
Formaldehyde được dùng để sản xuất nhựa (như poly(phenol-formaldehyde) và urea formaldehyde), sản xuất phẩm nhuộm, chất nổ và dược phẩm. Dung dịch 37 – 40% formaldehyde trong nước, được gọi là formalin, được dùng để ngâm xác động thực vật, tẩy uế, tiệt trùng.
Acetaldehyde (ethanal) được dùng nhiều trong tổng hợp hữu cơ để điều chế nhiều dược phẩm hoặc các chất
có ứng dụng trong thực tiễn.
Acetone được dùng làm dung môi trong sản xuất tơ nhân tạo, thuốc súng không khói,... được dùng nhiều trong tổng hợp hữu cơ như để tổng hợp bisphenol-A, chloroform, thuốc an thần solfonal,...
Bài 1
Công thức cấu tạo của acetone là
A. CH3COCH2CH3. B. CH3CH2COCH2CH3.
C. CH3COCH3. D. CH3CHO.
Phương pháp giải:
Acetone là ketone no, đơn, hở, trong phân tử có 3 nguyên tử carbon.
Lời giải chi tiết:
Công thức cấu tạo của acetone là CH3COCH3.
→ Chọn C.
Bài 2
Khử CH3COCH3 bằng LiAlH4, thu được sản phẩm là
A. ethanal. B. acetone. C. propan-1-ol. D. propan-2-ol.
Phương pháp giải:
Ketone bị khử bằng NaBH4 hoặc LiAlH4 sinh ra alcohol bậc hai.
Lời giải chi tiết:
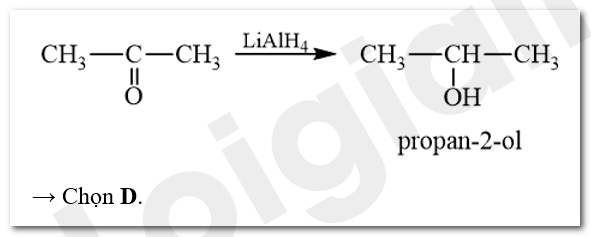
Bài 3
Viết công thức cấu tạo và gọi tên thay thế các aldehyde có cùng công thức C5H10O.
Phương pháp giải:
- Viết công thức cấu tạo của aldehyde no, đơn, hở có công thức C5H10O.
- Danh pháp thay thế của aldehyde:

Lời giải chi tiết:
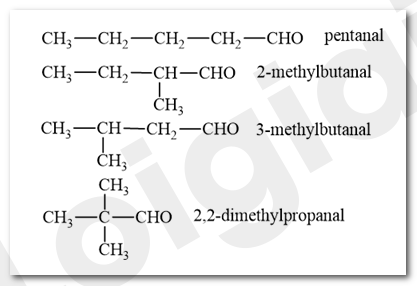
Bài 4
Viết công thức cấu tạo của các chất carbonyl có công thức phân tử là C3H6O.
Trình bày tối thiểu hai phương pháp hoá học để phân biệt các chất đó. Lập sơ đồ (hoặc bảng), ghi rõ hiện tượng và viết các phương trình hoá học để giải thích.
Phương pháp giải:
Viết công thức cấu tạo của aldehyde, ketone no, đơn, hở.
- Aldehyde phản ứng với thuốc thử Tollens, tạo lớp bạc bám (phản ứng tráng bạc). Ketone không có phản ứng với thuốc thử Tollens.
- Trong môi trường kiềm, Cu(OH)2 oxi hoá hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch. Ketone không có phản ứng với Cu(OH)2 (trong môi trường kiềm).
Lời giải chi tiết:
- Công thức cấu tạo của các chất carbonyl có công thức phân tử là C3H6O:
+ CH3COCH3
+ CH3CH2CHO
- Cách nhận biết:
|
Chất |
CH3COCH3 |
CH3CH2CHO |
|
Hiện tượng khi nhận biết bằng thuốc thử Tollens |
Không hiện tượng |
Kết tủa bạc |
|
Hiện tượng khi nhận biết bằng Cu(OH)2/OH- |
Không hiện tượng |
Kết tủa đỏ gạch |
- Phương trình:
CH3CH2CH=O + 2(Ag(NH3)2)OH → CH3CH2COONH4 +2Ag↓ + 3NH3 + H2O
CH3CH2CHO + 2Cu(OH)2 + NaOH CH3CH2COONa + Cu2O + 3H2O
Bài 5
Hợp chất hữu cơ X được dùng nhiều trong tổng hợp hữu cơ. Bằng phương pháp phân tích nguyên tố, người ta xác định được X chứa 62,07%C; 10,34%H; còn lại là O. Trên phổ MS của X, người ta thấy có peak ion phân tử (M) có giá trị m/z bằng 58. Trên phổ IR của X có một peak trong vùng 1 670 – 1 740 cm-1. Chất X không có phản ứng với Cu(OH)2 trong môi trường kiềm để tạo ra kết tủa màu đỏ gạch. Xác định công thức cấu tạo của X.
Phương pháp giải:
Xác định công thức phân tử của X dựa vào % nguyên tố và phân tử khối của X.
Trên phổ IR, peak của nhóm carbonyl trong vùng 1 670 – 1 740 cm-1.
Ketone không phản ứng với Cu(OH)2 trong môi trường kiềm.
Lời giải chi tiết:
Gọi công thức đơn giản nhất của X là CxHyOz
%O = 100% - (62,07% + 10,34%) = 27,59%
Ta có:
\(\begin{array}{l}{\rm{x : y : z = }}\frac{{{\rm{\% C}}}}{{{\rm{12}}}}{\rm{ : }}\frac{{{\rm{\% H}}}}{{\rm{1}}}{\rm{ : }}\frac{{{\rm{\% O}}}}{{{\rm{16}}}}\\{\rm{ = }}\frac{{{\rm{62,07}}}}{{{\rm{12}}}}{\rm{ : }}\frac{{{\rm{10,34}}}}{{\rm{1}}}{\rm{ : }}\frac{{{\rm{27,59}}}}{{{\rm{16}}}} \approx 5,17:10,34:1,72 \approx 3:6:1\end{array}\)
=> Công thức đơn giản nhất của X là C3H6O.
=> Công thức phân tử của X có dạng (C3H6O)n
Dựa vào kết quả phổ MS của X, phân tử khối của X là 58.
Ta có: (12.3 + 1.6 + 16)n = 58 ó 58n = 58 => \({\rm{n = }}\frac{{{\rm{58}}}}{{{\rm{58}}}}{\rm{ = 1}}\)
=> Công thức phân tử của X là C3H6O.
Vì phổ IR của X có một peak trong vùng 1 670 – 1 740 cm-1 nên X có nhóm carbonyl.
Vì X không có phản ứng với Cu(OH)2 trong môi trường kiềm để tạo ra kết tủa màu đỏ gạch nên X là ketone.
=> Công thức cấu tạo của X là: CH3COCH3.
Bài 6
Cho ba chất hữu cơ A, B, C có cùng công thức phân tử là C3H6O. Chất A có mạch carbon và có phản ứng tráng bạc; chất B không có phản ứng tráng bạc nhưng có phản ứng iodoform; chất C làm mất màu nước bromine. Khi hydrogen hoá C rồi oxi hoá sản phẩm thì được A. Xác định công thức cấu tạo và gọi tên A, B, C theo danh pháp thay thế
Phương pháp giải:
Aldehyde có phản ứng tráng bạc. Ketone không có phản ứng tráng bạc.
Hợp chất chứa nhóm methyl ketone (CH3CO-R )có phản ứng iodoform.
Hợp chất chứa liên kết π làm mất màu nước bromine, có phản ứng cộng hydrogen.
Oxi hóa không hoàn toàn alcohol bậc I, bậc II lần lượt thu được aldehyde hoặc ketone.
Lời giải chi tiết:
Ba chất hữu cơ A, B, C có cùng công thức phân tử là C3H6O.
Vì A có phản ứng tráng bạc nên A là aldehyde.
=> A có công thức cấu tạo: CH3CH2CHO.
Vì B có có phản ứng iodoform nên B chứa nhóm methyl ketone, mà B không có phản ứng tráng bạc.
=> B là ketone.
=> B có công thức cấu tạo: CH3COCH3.
Vì C làm mất màu nước bromine nên trong phân tử của C chứa liên kết π (liên kết bội). Khi hydrogen hoá C rồi oxi hoá sản phẩm thì được A => C có nhóm chức –OH (-OH phải liên kết với carbon no), C là alcohol bậc I.
=> Công thức phân tử của C là: CH2=CH-CH2-OH.
Lý thuyết
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều timdapan.com"







