Bài 15. Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học trang 82, 83, 84, 85, 86, 87 Hóa 10 Cánh diều
Cho hai phản ứng đốt cháy: Xác định dấu của trong các phản ứng được thể hiện trong hai hình dưới đây: Cho phản ứng: CH4(g) + H2O(l) → CO(g) + 3H2(g) = 250 kJ. Ở điều kiện chuẩn, để thu được 1 gam H2, phản ứng này cần hấp thu nhiệt lượng bằng bao nhiêu
MĐ
|
Cho hai phản ứng đốt cháy: (1) C(s) + O2(g) → CO2(g) ${\Delta _r},H_{298}^0$ = -393,5 kJ (2) 2Al(s) + 3/2 O2(g) → Al2O3(s) ${\Delta _r},H_{298}^0$ = -1675,7 kJ Với cùng một khối lượng C và Al, chất nào khi đốt cháy tỏa ra nhiều nhiệt hơn? |
Phương pháp giải:
Phản ứng tỏa nhiệt: biến thiên enthalpy có giá trị càng âm, phản ứng tỏa ra càng nhiều nhiệt.
Phản ứng thu nhiệt: biến thiên enthalpy có giá trị càng dương, phản ứng thu vào càng nhiều nhiệt.
Lời giải chi tiết:
Giả sử: 1 gam C và Al
+ 1 gam C có 1/12 mol
1 mol C : ${\Delta _r},H_{298}^0$ = -393,5 kJ
1/12 mol C ${\Delta _r},H_{298}^0$ = -32,79 kJ
+ 1 gam Al có 1/27 mol
2 mol Al : ${\Delta _r},H_{298}^0$= -1675,7 kJ
1/27mol Al : ${\Delta _r},H_{298}^0$= -31,03 kJ
⇒ Với cùng một khối lượng C và Al, C khi đốt cháy tỏa ra nhiều nhiệt hơn.
CH
|
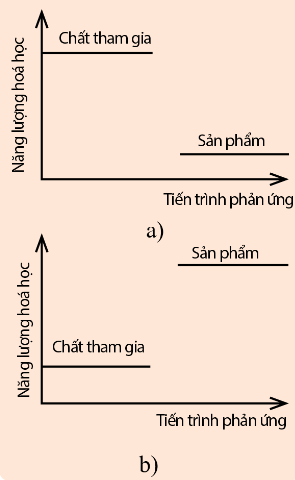
1. Xác định dấu của ${\Delta _r},H_{298}^0$ trong các phản ứng được thể hiện trong hai hình dưới đây:
|
Phương pháp giải:
Phản ứng tỏa nhiệt: năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm (kèm theo sự giải phóng năng lượng).
Phản ứng thu nhiệt: năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm (kèm theo sự hấp thu năng lượng).
+ ${\Delta _r},H_{298}^0$ < 0: phản ứng tỏa nhiệt.
+ ${\Delta _r},H_{298}^0$ > 0: phản ứng thu nhiệt.
Lời giải chi tiết:
a) Vì năng lượng chất tham gia cao hơn năng lượng của sản phẩm ⇒ phản ứng tỏa nhiệt ⇒ ${\Delta _r},H_{298}^0$ < 0.
b) Vì năng lượng chất tham gia thấp hơn năng lượng của sản phẩm ⇒ phản ứng thu nhiệt ⇒ ${\Delta _r},H_{298}^0$ > 0.
LT
| 1. Cho phản ứng:
CH4(g) + H2O(l) → CO(g) + 3H2(g) ${\Delta _r},H_{298}^0$= 250 kJ. Ở điều kiện chuẩn, để thu được 1 gam H2, phản ứng này cần hấp thu nhiệt lượng bằng bao nhiêu |
Phương pháp giải:
Giá trị enthalpy tỉ lệ thuận với lượng sản phẩm tạo thành của phản ứng
Lời giải chi tiết:
1 gam H2 ⇒ nH2 = $\frac{1}{2}$mol
3 mol H2 : ${\Delta _r},H_{298}^0$ = 250 kJ.
$\frac{1}{2}$ mol H2 : ${\Delta _r},H_{298}^0$ = 250. $\frac{1}{2}$ :3 = 41,67 kJ.
⇒ Để thu được 1 gam H2, phản ứng này cần hấp thu 41,67 kJ.
VD
| 1. Giải thích vì sao để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt (là loại nước mắm chứa nhiều chất đạm). |
Phương pháp giải:
Tham khảo 1 số nguồn: sách, báo, tivi, internet
Lời giải chi tiết:
Khi uống nước mắm, thường là mắm cốt với độ đạm cao, đồng nghĩa với chứa rất nhiều acid amin. Các acid amin này sẽ đc hấp thu nhanh chóng vào cơ thể cung cấp năng lượng. Giúp cơ thể có nguyên liệu để tăng sinh nhiệt.
Cùng với đó, lượng muối trong nước mắm thường rất cao. Khi uống vào sẽ khiến huyết áp tăng lên. Tim làm việc nhiều hơn để bơm lượng máu lớn hơn đi khắp cơ thể. Nước là chất giữ nhiệt tốt nên việc máu tăng lưu lượng giúp nhanh chóng điều hòa nhiệt độ cả cơ thể, nhanh chóng vận chuyển năng lượng đến các mô. Từ đó giúp cho cơ thể không bị lạnh.
VD
|
2. Khi đốt cháy tờ giấy hay đốt lò than, ta cần thực hiện giai đoạn khơi mào như thế nào? 3. Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò? |
Phương pháp giải:
2. Đốt nóng để gây phản ứng cho một lượng nhỏ chất ban đầu sau đó phản ứng tỏa nhiệt có thể tự tiếp diễn.
3. Nung vôi là phản ứng thu nhiệt, đốt than là phản ứng tỏa nhiệt
Lời giải chi tiết:
2. Đốt nóng để gây phản ứng cho một lượng nhỏ chất ban đầu sau đó phản ứng tỏa nhiệt có thể tự tiếp diễn.
3. Vì phản ứng nung vôi là phản ứng thu nhiệt từ quá trình đốt cháy than nên nếu không xếp lẫn than thì phản ứng nung sẽ không tiếp diễn.
CH
| 2. Phản ứng đốt cháy cồn hay phản ứng nung vôi dễ thực hiện hơn? |
Phương pháp giải:
Các phản ứng tỏa nhiệt (${\Delta _r},H_{298}^0$ < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (${\Delta _r},H_{298}^0$ > 0).
Lời giải chi tiết:
Phản ứng đốt cháy cồn là phản ứng tỏa nhiệt.
Phản ứng nung vôi là phản ứng thu nhiệt.
⇒ Phản ứng đốt cháy cồn dễ thực hiện hơn phản ứng nung vôi.
CH
| 3. CaSO4 là thành phần chính của thạch cao. Biết rằng
CaSO4(s) → CaO(s) + SO2(g) + O2(g) có ${\Delta _r},H_{298}^0$ = 1000,6 kJ. a) Phản ứng này thuận lợi hay không thuận lợi? b) Giải thích vì sao trong xây dựng, người ta sử dụng thạch cao để chế tạo các tấm vật liệu chịu nhiệt, chống cháy |
Phương pháp giải:
Các phản ứng tỏa nhiệt (${\Delta _r},H_{298}^0$ < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (${\Delta _r},H_{298}^0$ > 0).
Lời giải chi tiết:
a) Phản ứng này không thuận lợi vì ${\Delta _r},H_{298}^0$ > 0 (phản ứng thu nhiệt)
b) Để phân hủy thạch cao, cần một lượng nhiệt rất lớn và thạch cao sẽ thu hết nhiệt
=> Dùng làm vật liệu tản nhiệt, chống cháy
VD
| 4. Cho biết:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l) ${\Delta _r},H_{298}^0$ = 85 kJ NaHCO3 có trong thành phần bột nở dùng để làm bánh. Vì sao khi bảo quản, cần tránh để bột nở ở nơi có nhiệt độ cao? |
Phương pháp giải:
${\Delta _r},H_{298}^0$ > 0 => Phản ứng thu nhiệt, cần cung cấp nhiệt để phản ứng
Lời giải chi tiết:
${\Delta _r},H_{298}^0$ > 0 => Phản ứng thu nhiệt, cần cung cấp nhiệt để phản ứng
=> Khi để bột nở ở nơi có nhiệt độ cao, NaHCO3 sẽ bị phân hủy, không còn tính chất của bột nở
LT
| 2. Tính ${\Delta _r},H_{298}^0$các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4(g), C2H6(g), CO(g). Biết các sản phẩm thu được đều ở thể khí. |
Phương pháp giải:
- Các phương trình:
C2H4 + 3O2 → 2CO2 + 2H2O
C2H6 + 7/2 O2 → 2CO2 + 3H2O
CO + ½ O2 → CO2
- Tham khảo giá trị enthalpy ở phụ lục 3:
Lời giải chi tiết:
- Xét phản ứng đốt cháy 1 mol C2H4:
C2H4 (g) + 3O2 (g) → 2CO2 (g)+ 2H2O (g)
∆fH0298 = 2 x ∆fH0298 (CO2) + 2 x ∆fH0298 (H2O) - 3 x ∆fH0298 (O2) - 1 x ∆fH0298 (C2H4)
= -393,5 x 2 + -241,8 x 2 – 3 x 0 – 1 x 52,4 = -1323 kJ.mol-1
- Xét phản ứng đốt cháy 1 mol C2H6:
C2H6 (g) + 7/2 O2 (g) → 2CO2 (g)+ 3H2O (g)
∆fH0298 = 2 x ∆fH0298 (CO2) + 3 x ∆fH0298 (H2O) - 7/2 x ∆fH0298 (O2) - 1 x ∆fH0298 (C2H6)
= -393,5 x 2 + -241,8 x 3 –7/2 x 0 – 1 x -84 = -1428,4 kJ.mol-1
- Xét phản ứng đốt cháy 1 mol CO:
CO(g) + ½ O2 (g) → CO2(g)
∆fH0298 = 1 x ∆fH0298 (CO2) – 1/2 x ∆fH0298 (O2) - 1 x ∆fH0298 (CO)
= -393,5 x 1 – 1/2 x 0 – 1 x -110,5 = -283 kJ.mol-1
CH
|
4. Cho phản ứng sau ở điều kiện chuẩn: H-H(g) + F-F(g) -> 2H-F(g) Tính năng lượng cần để phá vỡ các liên kết trong H2, F2 và năng lượng tỏa ra (theo kJ) khi hình thành liên kết trong HF cho phản ứng trên. |
CH
| 5. Xác định số lượng mỗi loại liên kết trong các phân tử trước và sau phản ứng của CH4 với Cl2. |
Phương pháp giải:
Lời giải chi tiết:
- Trước phản ứng: có 4 liên kết C – H và 1 liên kết Cl – Cl
- Sau phản ứng: Có 3 liên kết C – H, 1 liên kết C – Cl, 1 liên kết H - Cl
12
| 3. Dựa vào năng lượng liên kết, tính ${\Delta _r},H_{298}^0$ các phản ứng sau:
a) Các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4, C2H6, H2 ở thể khí. b) F2(g) + H2O(g) → 2HF(g) + ½ O2(g) Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi. |
Phương pháp giải:
- Tham khảo số liệu ở bảng phụ lục 2:
C2H4 + 3O2 → 2CO2 + 2H2O
C2H6 + 7/2 O2 → 2CO2 + 3H2O
CO + ½ O2 → CO2
- Giá trị elthanpy âm thì phản ứng xảy ra thuận lợi
Lời giải chi tiết:
a)
- Xét phản ứng đốt cháy 1 mol C2H4
C2H4 (g) + 3O2 (g) → 2CO2 (g)+ 2H2O (g)
∆fH0298 = 1 x Eb (C2H4) + 3 x Eb (O2) - 2 x Eb (CO2) - 2 x Eb (H2O)
∆fH0298 = 1 x EC=C + 4 x EC-H + 3 x EO2 – 2 x 2EC=O – 2 x 2EO-H
∆fH0298 = 1x611 + 4x414 + 3x498 – 2x2x799 – 2x2x464 = -1291kJ
- Xét phản ứng đốt cháy 1 mol C2H6
C2H6 (g) + 7/2 O2 (g) → 2CO2 (g)+ 3H2O (g)
∆fH0298 = 1 x Eb (C2H6) + 7/2 x Eb (O2) - 2 x Eb (CO2) - 3 x Eb (H2O)
∆fH0298 = 1 x EC-C + 6 x EC-H + 7/2 x EO2 – 2 x 2EC=O – 3 x 2EO-H
∆fH0298 = 1x347 + 6x414 + 7/2 x498 – 2x2x799 – 3x2x464 = -1406kJ
- Xét phản ứng đốt cháy 1 mol CO
CO(g) + ½ O2 (g) → CO2(g)
∆fH0298 = 1 x Eb (CO) + 1/2 x Eb (O2) - 1 x Eb (CO2)
∆fH0298 = 1 x ECO + 1/2 x EO2 – 1 x 2EC=O
∆fH0298 = 1 x 1072 + 1/2 x 498– 1x2x799 = -277kJ
b)
F2(g) + H2O(g) → 2HF(g) + ½ O2 (g)
∆fH0298 = 1 x Eb (F2) + 1 x Eb (H2O) - 2 x Eb (HF) – 1/2 x Eb (O2)
∆fH0298 = 1 x EF-F + 1x2EO-H - 2 x EH-F - 1/2 x EO2
∆fH0298 = 1 x 159 + 2x464– 2x565 - 1/2 x 498= -292kJ
Các phản ứng trên đều có giá trị elthanpy âm => Các phản ứng trên đều thuận lợi
VD
| 5.Phản ứng quang hợp là phản ứng thu năng lượng dưới dạng ánh sáng:
6nCO2(g) + 6nH2O(l) → (C6H12O6)n(s) + 6nO2(g) Hãy tính xem cần phải cung cấp bao nhiêu năng lượng dưới dạng ánh sáng cho phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s), biết enthalpy tạo thành chuẩn của chất này là -1271,1 kJ.mol-1. Biến thiến enthalpy tạo thành chuẩn của các chất khác tra ở phụ lục 3, trang 119. |
Phương pháp giải:
Enthalpy của phản ứng bằng tổng enthalpy tạo thành các chất sản phẩm trừ tổng enthalpy tạo thành các chất phản ứng
Lời giải chi tiết:
6nCO2(g) + 6nH2O(l) → (C6H12O6)n(s) + 6nO2(g)
∆fH0298 = ∆fH0298 (C6H12O6) + 6 x ∆fH0298 (O2) - 6 x ∆fH0298 (CO2) - 6 x ∆fH0298 (H2O)
= -1271,1 + 6 x 0 – 6 x -393,5 – 6 x -285,8 = 2804,7 kJ.mol-1
=> Phải cung cấp 2804,7 kJ dưới dạng ánh sáng cho phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s)
1
|
Bài 1. Cho phản ứng: N2(g) + 3H2(g) → 2NH3(g) ${\Delta _r},H_{298}^0$ = -92,22 kJ. a) Trong nhà máy sản xuất NH3, ban đầu phải đốt nóng N2 và H2 để phản ứng diễn ra. Nhiệt tỏa ra từ phản ứng này lại được dùng để đốt nóng hỗn hợp N2 và H2 cho quá trình phản ứng tiếp theo. Cách làm này có ý nghĩa gì về khía cạnh kinh tế? Giải thích b) Tính enthalpy tạo thành chuẩn của NH3. |
Phương pháp giải:
a) Tiết kiệm kinh tế
b) Enthalpy của phản ứng bằng tổng enthalpy tạo thành các chất sản phẩm trừ tổng enthalpy tạo thành các chất phản ứng
Lời giải chi tiết:
a)Phản ứng sản xuất NH3 là phản ứng tỏa nhiệt, lượng nhiệt tỏa ra dùng để đốt nóng hỗn hợp N2 và H2 cho phản ứng tiếp tục xảy ra
=> Tiết kiệm nhiên liệu đốt cho quá trình phản ứng
b) N2(g) + 3H2(g) → 2NH3(g) ${\Delta _r},H_{298}^0$= -92,22 kJ
Ta có: -92,22 = 2 x ∆fH0298 (NH3) – 1 x ∆fH0298 (N2) - 3 x ∆fH0298 (H2)
=> -92,22 = 2 x ∆fH0298 (NH3) – 0 – 0
=> ∆fH0298 (NH3) = -46,11 kJ
2
| Bài 2.Tính ${\Delta _r},H_{298}^0$ cho phản ứng sau dựa theo năng lượng liên kết.
CH4(g) + X2(g) → CH3X(g) + HX(g) Với X = F, Cl, Br, I. Liên hệ giữa mức độ phản ứng (dựa theo ${\Delta _r},H_{298}^0$) với tính phi kim (F > Cl > Br > I). Tra các giá trị năng lượng liên kết của Phụ lục 2, trang 118 |
Phương pháp giải:
Biến thiên enthalpy phản ứng bằng tổng năng lượng liên kết của các chất phản ứng trừ tổng năng lượng các chất sản phẩm
Lời giải chi tiết:
- Xét X là F:
CH4(g) + F2(g) → CH3F(g) + HF(g)
∆fH0298 = 1 x Eb (CH4) + 1 x Eb (F2) - 1 x Eb (HF) - x Eb (CH3F)
∆fH0298 = 1 x 4EC-H + 1 x EF-F - 1 x EH-F - 1 x (3EC-H + EC-F)
∆fH0298 = 1x4 x414 + 1x159– 1x565 - 1x(3x414 + 1x485)= -477kJ
- Xét X là Cl:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
∆fH0298 = 1 x Eb (CH4) + 1 x Eb (Cl2) - 1 x Eb (HCl) - x Eb (CH3Cl)
∆fH0298 = 1 x 4EC-H + 1 x ECl-Cl - 1 x EH-Cl - 1 x (3EC-H + EC-Cl)
∆fH0298 = 1x4 x414 + 1x243– 1x431 - 1 x(3x414 + 1x339)= -113kJ
- Xét X là Br:
CH4(g) + Br2(g) → CH3Br(g) + HBr(g)
∆fH0298 = 1 x Eb (CH4) + 1 x Eb (Br2) - 1 x Eb (HBr) - x Eb (CH3Br)
∆fH0298 = 1 x 4EC-H + 1 x EBr-Br - 1 x EH-Br - 1 x (3EC-H + EC-Br)
∆fH0298 = 1x4 x414 + 1x193– 1x364 - 1 x(3x414 + 1x276)= -33kJ
- Xét X là I:
CH4(g) + I2(g) → CH3I(g) + HI(g)
∆fH0298 = 1 x Eb (CH4) + 1 x Eb (I2) - 1 x Eb (HI) - x Eb (CH3I)
∆fH0298 = 1 x 4EC-H + 1 x EI-I - 1 x EH-I - 1 x (3EC-H + EC-I)
∆fH0298 = 1x4 x414 + 1x151– 1x297 - 1 x(3x414 + 1x240)= 28kJ
=> Từ F đến I, tính phi kim giảm dần nên khả năng tham gia phản ứng giảm dần
3
|
Bài 3*. Khi đun bếp than, củi, để đun nấu nhanh hơn, người ta thường dùng quạt để thổi thêm không khí vào bếp. Cách làm này có làm thay đổi biến thiên enthalpy chuẩn của phản ứng C(s) + O2(g) → CO2(g) không? Giải thích. |
Lời giải chi tiết:
Cách làm này chỉ làm tăng tốc độ phản ứng chứ không làm thay đổi biến thiên enthalpy chuẩn của phản ứng
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 15. Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học trang 82, 83, 84, 85, 86, 87 Hóa 10 Cánh diều timdapan.com"