Bài 35.14; 35.15; 35.16 trang 86 SBT Hóa học 12
Giải bài 35.14; 35.15; 35.16 trang 86 Sách bài tập hóa học 12 - Cho sơ đồ sau :
Câu 35.14.
Cho sơ đồ sau :
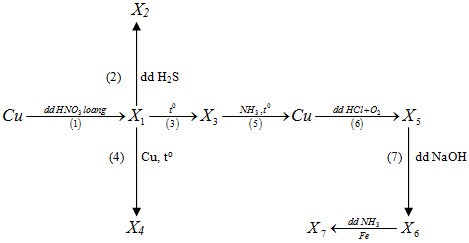
Biết các chất từ X1 đến X7 đều là các hợp chất của đồng. Trong sơ đồ trên số phản ứng oxi hoá - khử là
A.4. B. 5.
C. 6. D.7
Phương pháp
Dựa vào tính chất của đồng và các hợp chất của đồng
Giải chi tiết
(1) 3Cu + 8HNO3 loãng \( \to\) 3Cu(NO3)2 (X1) + 2NO + 4H2O
(2) Cu(NO3)2 + H2S \( \to\) CuS (X2) + 2HNO3
(3) 2Cu(NO3)2 \( \to\) 2CuO (X3) + 4NO2 + O2
(4) CuO + Cu \( \to\) Cu2O
(5) 3CuO + 2NH3 \( \to\) 3Cu + N2 + 3H2O
(6) 2Cu + 4HCl + O2 \( \to\) 2CuCl2 + 2H2O
(7) CuCl2 + 2NaOH \( \to\) Cu(OH)2 + 2NaCl
(8) Cu(OH)2 + 4NH3 \( \to\) [Cu(NH3)4](OH)2
Fe + [Cu(NH3)4](OH)2 \( \to\) [Fe(NH3)4](OH)2 + Cu
Các phản ứng oxi hóa khử là (1), (3), (4), (5), (6), (8)
\( \to\) Chọn B.
Câu 35.15.
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
A. 0,04. B. 0,075.
C. 0,12. D. 0,06.
Phương pháp
Dung dịch X thu được chứa Fe2(SO4)3 và CuSO4
\( \to\) Dung dịch X gồm: Fe3+ (0,12 mol), Cu2+ (2a mol), \(SO_4^{2 - }\) (0,24 + a) mol
Bảo toàn điện tích cho dung dịch X tìm được a.
Giải chi tiết
Dung dịch X thu được chứa Fe2(SO4)3 và CuSO4
\( \to\) Dung dịch X gồm: Fe3+ (0,12 mol), Cu2+ (2a mol), \(SO_4^{2 - }\) (0,24 + a) mol
Bảo toàn điện tích cho dung dịch X: \(3{n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} = 2{n_{SO_4^{2 - }}}\)
3.0,12 + 2.2a = 2.(0,24 + a ) \( \to\) a = 0,06
\( \to\) Chọn D.
Câu 35.16.
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu đươc dung dich A và 224 ml khí NO duy nhât (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
A. 0,1M. B. 0,25M.
C.0,2M. D. 0,5M.
Phương pháp
Viết phương trình bán phản ứng của HNO3, tính số mol HNO3 theo NO, từ đó tìm được nồng độ mol của dung dịch HNO3 đã dùng
Giải chi tiết
Ta dùng phương trình bán phản ứng của HNO3:
\(\eqalign{
& 4HN{O_3} + 3{\rm{e}} \to NO + 3NO_3^ - + 2{H_2}O \cr
& {n_{NO}} = 0,01\,mol \Rightarrow {n_{HN{O_3}}} = 0,04\,mol \cr
& \Rightarrow {C_{M\left( {HN{O_3}} \right)}} = {{0,04} \over {0,2}} = 0,2M \cr} \)
\( \to\) Chọn C.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 35.14; 35.15; 35.16 trang 86 SBT Hóa học 12 timdapan.com"







