Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 3
Câu 1: Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi: A. Tốc độ phản ứng thuận bằng hai lần tốc độ phản ứng nghịch B. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch C. Tốc độ phản ứng thuận bằng một nửa tốc độ phản ứng nghịch D. Tốc độ phản ứng thuận bằng k lần tốc độ phản ứng nghịch
Đề thi
I. Trắc nghiệm (6 điểm)
Câu 1: Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi:
A. Tốc độ phản ứng thuận bằng hai lần tốc độ phản ứng nghịch
B. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
C. Tốc độ phản ứng thuận bằng một nửa tốc độ phản ứng nghịch
D. Tốc độ phản ứng thuận bằng k lần tốc độ phản ứng nghịch
Câu 2: Cân bằng hóa học là cân bằng
A.. Động
B. Tĩnh
C. Ổn định
D. Đều
Câu 3: Xét cân bằng: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\)
Biểu thức hằng số cân bằng của phản ứng là:
A. \({K_C} = \frac{{{\rm{[}}N{H_3}]}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}}\)
B. \({K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^2}}}\)
C. \({K_C} = \frac{{{\rm{[}}{N_2}]{\rm{[}}{H_2}]}}{{{\rm{[}}N{H_3}]}}\)
D. \({K_C} = \frac{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^2}}}{{{{{\rm{[}}N{H_3}]}^2}}}\)
Câu 4: Ở nhiệt độ nhất định, phản ứng thuận nghịch: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) đạt trạng thái cân bằng khi nồng độ của các chất như sau: [H2] = 2M; [N2] = 0,01M; [NH3] = 0,4M. Hằng số cân bằng ở nhiệt độ có giá trị là?
A. 2 B. 3 C. 5 D. 7
Câu 5: Cho phương trình: \({S^{2 - }} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - } + O{H^ - }\). Phát biểu nào sau đây là đúng?
A. H2O là base B. S2- là base
C. HS- là base D. S2- là acid
Câu 6: Dung dịch NaOH 0,01M có giá trị pH là
A. 2 B. 1 C. 13 D. 12
Câu 7: Chuẩn độ 20ml dung dịch HCl chưa biết nồng độ đã dùng hết 17ml dung dịch NaOH 0,12M. Nồng độ mol của dung dịch HCl là:
A. 0,2M B. 0,102M C. 0,1M D. 0,21M
Câu 8: Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1. B. 1s22s22p5.
C. 1s22s22p4. D. 1s22s22p3.
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ nào sau đây?
A. Tinh bột B. Cellulose C. Protein D. Glucose
Câu 10: Khí nào sau đây dễ tan trong nước do tạo được liên kết kydrogen với nước:
A. Nitrogen B. Hydrogen C. Ammnonia D. Oxygen
Câu 11: Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
A. Hồng B. Xanh C. Không màu D. Vàng
Câu 12: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 1. D. 4.
Câu 13: Xét phản ứng trong quá trình tạo ra NOx nhiệt:
\({N_2}(g) + {O_2}(g) \to 2NO(g)\) \({\Delta _r}H_{298}^o = 180,6kJ\)
Nhiệt tạo thành chuẩn của NO(g) là
A. 180,6 kJ/mol B. -180,6 kJ/mol
C. -90,3 kJ/mol D. 90,3 kJ/mol
Câu 14: Phát biểu nào sau đây là không đúng khi nói về ammnonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Câu 15: Cho 100 ml dung dịch NH4Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
II. Tự luận (4 điểm)
Câu 1 (2 điểm): Ethanol và propanoic acid phản ứng với nhau tạo thành ethy propanoate theo phản ứng hóa học sau: \({C_2}{H_5}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {C_2}{H_5}COO{C_2}{H_5}(l) + {H_2}O(l)\)
Ở 500C, giá trị KC của phản ứng trên là 7,5. Nếu cho 23,0 g ethanol phản ứng với 37,0 g propanoic acid ở 500C thì khối lượng của ethy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Câu 2 (2 điểm):Trộn lẫn 3 dung dịch H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300ml dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2M và KOH 0,29M thu được dung dịch Z có pH = 2. Tính giá trị của V.
---Hết---
Đáp án
Phần trắc nghiệm
|
1B |
2A |
3B |
4A |
5B |
6D |
7B |
8D |
|
9C |
10C |
11A |
12B |
13D |
14B |
15A |
|
Câu 1: Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi:
A. Tốc độ phản ứng thuận bằng hai lần tốc độ phản ứng nghịch
B. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
C. Tốc độ phản ứng thuận bằng một nửa tốc độ phản ứng nghịch
D. Tốc độ phản ứng thuận bằng k lần tốc độ phản ứng nghịch
Phương pháp
Dựa vào khái niệm cân bằng hóa học
Lời giải
=> Đáp án B
Câu 2: Cân bằng hóa học là cân bằng
A. Động
B. Tĩnh
C. Ổn định
D. Đều
Phương pháp
Cân bằng hóa học là cân bằng động do tại thời điểm đó phản ứng hóa học vẫn xảy ra
Lời giải
=> Đáp án A
Câu 3: Xét cân bằng: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\)
Biểu thức hằng số cân bằng của phản ứng là:
A. \({K_C} = \frac{{{\rm{[}}N{H_3}]}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}}\)
B. \({K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^3}}}\)
C. \({K_C} = \frac{{{\rm{[}}{N_2}]{\rm{[}}{H_2}]}}{{{\rm{[}}N{H_3}]}}\)
D. \({K_C} = \frac{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^2}}}{{{{{\rm{[}}N{H_3}]}^2}}}\)
Phương pháp
Dựa vào hằng số cân bằng hóa học KC
Lời giải
=> Đáp án B
Câu 4: Ở nhiệt độ nhất định, phản ứng thuận nghịch: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) đạt trạng thái cân bằng khi nồng độ của các chất như sau: [H2] = 2M; [N2] = 0,01M; [NH3] = 0,4M. Hằng số cân bằng ở nhiệt độ có giá trị là?
A. 2 B. 3 C. 5 D. 7
Phương pháp
Dựa vào biểu thức tính hằng số cân bằng hóa học KC
Lời giải
\({K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{{{\rm{[}}{H_2}]}^3}.{\rm{[}}{N_2}]}} = \frac{{0,{4^2}}}{{{2^3}.0,01}} = 2\)
=> Đáp án A
Câu 5: Cho phương trình: \({S^{2 - }} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - } + O{H^ - }\). Phát biểu nào sau đây là đúng?
A. H2O là base B. S2- là base
C. HS- là base D. S2- là acid
Phương pháp
Dựa vào thuyết Bronsted – Lowry
Lời giải
S2- nhận H+ để tạo thành HS- nên S2- đóng vai trò là base
=> Đáp án B
Câu 6: Dung dịch NaOH 0,01M có giá trị pH là
A. 2 B. 1 C. 13 D. 12
Phương pháp
Dựa vào công thức tính pH
Lời giải
[OH-]=0,01M à [H+] = 10-12M à pH = -lg ([H+]) = 12
Câu 7: Chuẩn độ 20ml dung dịch HCl chưa biết nồng độ đã dùng hết 17ml dung dịch NaOH 0,12M. Nồng độ mol của dung dịch HCl là:
A. 0,2M B. 0,102M C. 0,1M D. 0,21M
Phương pháp
Dựa vào công thức chuẩn độ dung dịch acid – base
Lời giải
\({C_{HCl}}.{V_{HCl}} = {C_{NaOH}}.{V_{NaOH}} \to {C_{HCl}} = \frac{{{C_{NaOH}}.{V_{NaOH}}}}{{{V_{HCl}}}} = \frac{{17.0,12}}{{20}} = 0,102M\)
Câu 8: Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1. B. 1s22s22p5.
C. 1s22s22p4. D. 1s22s22p3.
Lời giải
=> Đáp án D
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ nào sau đây?
A. Tinh bột B. Cellulose C. Protein D. Glucose
Phương pháp
Dựa vào trạng thái tự nhiên của đơn chất nitrogen
Lời giải
Nitrogen tồn tại trong protein
=> Đáp án C
Câu 10: Khí nào sau đây dễ tan trong nước do tạo được liên kết hydrogen với nước:
A. Nitrogen B. Hydrogen C. Ammnonia D. Oxygen
Phương pháp
Dựa vào liên kết trong đơn chất hoặc hợp chất
Lời giải
Khí có liên kết hydrogen khi tan trong nước sẽ tạo liên kết hydrogen với nước.
=> Đáp án C
Câu 11: Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
A. Hồng B. Xanh C. Không màu D. Vàng
Phương pháp
Dựa vào tính chất hóa học của dung dịch NH3
Lời giải
Dung dịch NH3 có tính base nên phenolphthaleiun chuyển màu hồng
Câu 12: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 1. D. 4.
Phương pháp
Dựa vào tính chất của ammonia
Lời giải
(1) Đúng
(2) Đúng
(3) Sai, vì NH3 có tính base
(4) Đúng
=> Đáp án B
Câu 13: Xét phản ứng trong quá trình tạo ra NOx nhiệt:
\({N_2}(g) + {O_2}(g) \to 2NO(g)\) \({\Delta _r}H_{298}^o = 180,6kJ\)
Nhiệt tạo thành chuẩn của NO(g) là
A. 180,6 kJ/mol B. -180,6 kJ/mol
C. -90,3 kJ/mol D. 90,3 kJ/mol
Phương pháp
Dựa vào công thức tính nhiệt phản ứng
Lời giải
Vì N2, O2 là đơn chất nên nhiệt tạo thành bằng 0
\(\begin{array}{l} \to 2{\Delta _f}H_{298}^oNO = {\Delta _r}H_{298}^o\\ \to {\Delta _f}H_{298}^oNO = 180,6:2 = 90,3kJ\end{array}\)
Câu 14: Phát biểu nào sau đây là không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Phương pháp
Dựa vào tính chất của ammonia
Lời giải
=> Đáp án B sai vì NH3 được sử dụng làm nguyên liệu làm phân bón
Câu 15: Cho 100 ml dung dịch NH4Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
Phương pháp
Viết phản ứng của NH4Cl và NaOH
Lời giải
\(N{H_4}Cl + NaOH \to NaCl + N{H_3} + {H_2}O\)
0,1--> 0,1
VNH3 = 0,1.24,79 = 2,479 lít
=> Đáp án A
Câu 1: Ethanol và propanoic acid phản ứng với nhau tạo thành ethy propanoate theo phản ứng hóa học sau: \({C_2}{H_5}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {C_2}{H_5}COO{C_2}{H_5}(l) + {H_2}O(l)\)
Ở 500C, giá trị KC của phản ứng trên là 7,5. Nếu cho 23,0 g ethanol phản ứng với 37,0 g propanoic acid ở 500C thì khối lượng của ethy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Lời giải
\(\begin{array}{l}{n_{{C_2}{H_5}OH}} = \frac{{23}}{{46}} = 0,5mol\\{n_{C2H5COOH}} = \frac{{37}}{{74}} = 0,5mol\end{array}\)
Gọi V là thể tích của hỗn hợp ban đầu.
Gọi x là nồng độ của C2H5COOC2H5
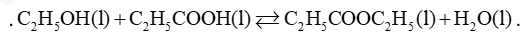
Trước phản ứng: 0,5 0,5 0 0
Phản ứng: x x x x
Sau phản ứng: 0,5 – x 0,5 – x x x
\(\begin{array}{l}{K_C} = \frac{{{\rm{[}}{C_2}{H_5}COO{C_2}{H_5}]{\rm{[}}{H_2}O]}}{{{\rm{[}}{C_2}{H_5}OH]{\rm{[}}{C_2}{H_5}COOH]}} = 7,5\\ \to \frac{{\frac{x}{V}.\frac{x}{V}}}{{\frac{{0,5 - x}}{V}.\frac{{0,5 - x}}{V}}} = 7,5\\ \to \left[ \begin{array}{l}{x_1} = 0,366 \to {m_{{C_2}{H_5}COO{C_2}{H_5}}} = 0,366.102 = 37,332g\\{x_2} = 0,788(loai)\end{array} \right.\end{array}\)
Câu 2: Trộn lẫn 3 dung dịch H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300ml dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2M và KOH 0,29M thu được dung dịch Z có pH = 2. Tính giá trị của V.
Lời giải
\(\begin{array}{l}\sum {{n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} + {n_{HCl}} + {n_{HN{O_3}}}} = 2.0,1.0,3 + 0,3.0,3 + 0,3.0,2 = 0,21mol\\\sum {{n_{O{H^ - }}} = {n_{KOH}} + {n_{NaOH}} = V.0,29 + V.0,2 = 0,49V(mol)} \end{array}\)
\({H^ + } + O{H^ - } \to {H_2}O\)
0,21 0,49V
Vì pH = 2 nên acid còn dư \( \to \) [H+] = 10-2 \( \to \) nH+ dư = 10-2.(0,3 + V)
Theo phản ứng: nH+ dư = 0,21 – 0,49V = 10-2. (0,3+V) \( \to \)V = 0,414 lít
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 3 timdapan.com"







