Đề thi giữa kì 1 Hóa 10 Kết nối tri thức - Đề số 6
Câu 1. Số thứ tự ô nguyên tố không cho biết: A. số proton trong hạt nhân. B. số neutron trong hạt nhân. C. số hiệu nguyên tử. D. số electron ở lớp vỏ.
Đề thi
Câu 1. Số thứ tự ô nguyên tố không cho biết:
A. số proton trong hạt nhân. B. số neutron trong hạt nhân.
C. số hiệu nguyên tử. D. số electron ở lớp vỏ.
Câu 2. Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
A. số electron thuộc lớp ngoài cùng như nhau. B. số lớp electron như nhau.
C. cùng số electron s hay p. D. số electron như nhau.
Câu 3. Xét các nguyên tố nhóm IA của bảng hệ thống tuần hoàn, điều khẳng định nào sau đây là đúng? Các nguyên tố nhóm IA:
A. dễ dàng cho 1 electron để đạt cấu hình bền vững.
B. nhận thêm 1 electron để đạt cấu hình bền vững.
C. được gọi là các kim loại kiềm thổ.
D. dễ dàng cho 2 electron để đạt cấu hình bền vững.
Câu 4. Nguyên tố X có cấu hình electron: 1s22s22p63s23p4.Vị trí X trong bảng tuần hoàn:
A. Chu kỳ 4, nhóm IVA. B. Chu kỳ 3,nhóm IVA.
C. Chu kỳ 3, nhóm VIA. D. Chu kỳ 6, nhóm VIA.
Câu 5. Nguyên tử R có cấu hình electron 1s22s22p63s23p4. Công thức hợp chất oxit cao nhất là:
A. R2O3. B. RO2. C. R2O5. D. RO3.
Câu 6. Dãy nguyên tố nào sau đây được xếp đúng theo thứ tự giảm dần độ âm điện?
(Cho \({Z_F} = 9,\,\,{Z_O} = 16,\,\,{Z_P} = 15,\,\,{Z_N} = 7\))
A. F, O, P, N. B. O, F, N, P, C. F, O, N, P. D. F, N, O, P.
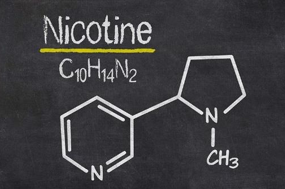
Câu 7. Nicotine có trong thuốc lá, là một chất rất độc, có thể gây nhiễm độc nghiêm trọng và gây tử vong, hấp thụ vào cơ thể qua đường tiêu hóa, hô hấp và da. Người ta đã tính ra được hút một điếu thuốc lá là tự tước đi của mình 5,5 phút sự sống. Hút thuốc lá làm tăng thêm tỉ lệ tử vong từ 30-80%, chủ yếu là các bệnh gây ung thư, bệnh tắc nghẽn mãn tính.. Nêu vị trí các nguyên tố tạo nên nicotine trong bảng tuần hoàn.
A. C (chu kì 4, nhóm IVA), H (chu kì 1, Nhóm IA), N (chu kì 2, nhóm VIA).
B. C (chu kì 2, nhóm IVA), H(chu kì 1, nhóm IA), N(chu kì 2, nhóm VA).
C. C (chu kì 2, nhóm VIA), H(chu 1, nhóm IA), N(chu kì 3, nhóm IIA).
D. C (chu kì 4, nhóm IVA), H (chu kì 1, Nhóm IA), N (chu kì 2, nhóm VIA).
Câu 8. Silicon là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ. Xác định vị trí của nguyên tố silicon (Z = 14) trong bảng tuần hoàn.
A. Ô 14, chu kì 3, nhóm IVA. B. Ô 14, chu kì 4, nhóm IVA.
C. Ô 14, chu kì 4, nhóm IIIA. D. Ô 14, chu kì 3, nhóm IIIA.
Câu 9. Thời Trung Hoa cổ đại loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thủy ngân và lưu huỳnh. Năm 1649 loài người đã tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Vây nguyên tố ở ô thứ 35 là nguyên tố nào sau đây?
A. Rb. B. Sr. C. Kr. D. Br.
Câu 10. Nguyên tử nguyên tố R có tổng số hạt mang điện và không mang điện là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu và vị trí của R (chu kì, nhóm) trong bảng tuần hoàn là
A. Na, chu kì 3, nhóm IA. B. Mg, chu kì 3, nhóm IIA.
C. F, chu kì 2, nhóm VIIA. D. Ne, chu kì 2, nhóm VIIIA.
II. TỰ LUẬN
Bài 1. Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn các nguyên tố hóa học và có tổng số đơn vị điện tích hạt nhân bằng 25.
a) Xác định số hiệu của X, Y.
b) Viết cấu hình electron nguyên tử X, Y và cho biết vị trí X, Y trong bảng tuần hoàn.
Bài 2. Hòa tan hoàn toàn 20 gam hỗn hợp 2 kim loại kiềm thổ A và B thuộc 2 chu kì liên tiếp vào dung dịch HCl dư thu được 15,68 lít khí (đktc). Xác định tên 2 kim loại kiềm thổ và thành phần % về khối lượng của mỗi kim loại trong hỗn hợp.
Đáp án
Đáp án trắc nghiệm
|
1B |
2C |
3A |
4C |
5D |
|
6C |
7B |
8A |
9D |
10A |
Câu 1. Số thứ tự ô nguyên tố không cho biết:
A. số proton trong hạt nhân. B. số neutron trong hạt nhân.
C. số hiệu nguyên tử. D. số electron ở lớp vỏ.
Phương pháp giải
Dựa vào kiến thức về nguyên tố hóa học
Lời giải chi tiết
Đáp án B
Câu 2. Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
A. số electron thuộc lớp ngoài cùng như nhau. B. số lớp electron như nhau.
C. cùng số electron s hay p. D. số electron như nhau.
Phương pháp giải
Các nguyên tố nhóm A có cùng số electron s hay p ở vỏ nguyên tử nên tính chất hóa học tương tự nhau
Lời giải chi tiết
Đáp án C
Câu 3. Xét các nguyên tố nhóm IA của bảng hệ thống tuần hoàn, điều khẳng định nào sau đây là đúng? Các nguyên tố nhóm IA:
A. dễ dàng cho 1 electron để đạt cấu hình bền vững.
B. nhận thêm 1 electron để đạt cấu hình bền vững.
C. được gọi là các kim loại kiềm thổ.
D. dễ dàng cho 2 electron để đạt cấu hình bền vững.
Phương pháp giải
Các nguyên tố kim loại nhóm A có xu hướng cho đi electron lớp ngoài cùng để đạt cấu hình bền vững
Lời giải chi tiết
Đáp án A
Câu 4. Nguyên tố X có cấu hình electron: 1s22s22p63s23p4.Vị trí X trong bảng tuần hoàn:
A. Chu kỳ 4, nhóm IVA. B. Chu kỳ 3,nhóm IVA.
C. Chu kỳ 3, nhóm VIA. D. Chu kỳ 6, nhóm VIA.
Phương pháp giải
Dựa vào cấu hình electron để biện luận số hiệu nguyên tử, chu kì và nhóm nguyên tố
Lời giải chi tiết
Nguyên tử X có 3 lớp electron => chu kì 3; lớp ngoài cùng có 6 electron => nhóm VIA
Đáp án C
Câu 5. Nguyên tử R có cấu hình electron 1s22s22p63s23p4. Công thức hợp chất oxit cao nhất là:
A. R2O3. B. RO2. C. R2O5. D. RO3.
Phương pháp giải
Dựa vào số electron lớp ngoài cùng của nguyên tử R
Lời giải chi tiết
Nguyên tử R có 6 electron lớp ngoài cùng ® hóa trị cao nhất với oxygen là 6 ® Công thức oxide: RO3
Đáp án D
Câu 6. Dãy nguyên tố nào sau đây được xếp đúng theo thứ tự giảm dần độ âm điện?
(Cho \({Z_F} = 9,\,\,{Z_O} = 16,\,\,{Z_P} = 15,\,\,{Z_N} = 7\))
A. F, O, P, N. B. O, F, N, P, C. F, O, N, P. D. F, N, O, P.
Phương pháp giải
Dựa vào điện tích hạt nhân nguyên tử.
Trong cùng một nhóm, độ âm điện giảm dần từ trên xuống
Trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải
Lời giải chi tiết
Đáp án C
Câu 7. Nicotine có trong thuốc lá, là một chất rất độc, có thể gây nhiễm độc nghiêm trọng và gây tử vong, hấp thụ vào cơ thể qua đường tiêu hóa, hô hấp và da. Người ta đã tính ra được hút một điếu thuốc lá là tự tước đi của mình 5,5 phút sự sống. Hút thuốc lá làm tăng thêm tỉ lệ tử vong từ 30-80%, chủ yếu là các bệnh gây ung thư, bệnh tắc nghẽn mãn tính.. Nêu vị trí các nguyên tố tạo nên nicotine trong bảng tuần hoàn.
A. C (chu kì 4, nhóm IVA), H (chu kì 1, Nhóm IA), N (chu kì 2, nhóm VIA).
B. C (chu kì 2, nhóm IVA), H(chu kì 1, nhóm IA), N(chu kì 2, nhóm VA).
C. C (chu kì 2, nhóm VIA), H(chu 1, nhóm IA), N(chu kì 3, nhóm IIA).
D. C (chu kì 4, nhóm IVA), H (chu kì 1, Nhóm IA), N (chu kì 2, nhóm VIA).
Phương pháp giải
Dựa vào kiến thức của các nguyên tố cấu tạo nên nicotine trong bảng tuần hoàn
Lời giải chi tiết
Đáp án B
Câu 8. Silicon là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. Silicon siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ. Xác định vị trí của nguyên tố silicon (Z = 14) trong bảng tuần hoàn.
A. Ô 14, chu kì 3, nhóm IVA. B. Ô 14, chu kì 4, nhóm IVA.
C. Ô 14, chu kì 4, nhóm IIIA. D. Ô 14, chu kì 3, nhóm IIIA.
Phương pháp giải
Dựa vào Z = 14 viết cấu hình của Si từ đó xác định vị trí của Si
Lời giải chi tiết
Đáp án A
Câu 9. Thời Trung Hoa cổ đại loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thủy ngân và lưu huỳnh. Năm 1649 loài người đã tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Vây nguyên tố ở ô thứ 35 là nguyên tố nào sau đây?
A. Rb. B. Sr. C. Kr. D. Br.
Lời giải chi tiết
Đáp án D
Câu 10. Nguyên tử nguyên tố R có tổng số hạt mang điện và không mang điện là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu và vị trí của R (chu kì, nhóm) trong bảng tuần hoàn là
A. Na, chu kì 3, nhóm IA. B. Mg, chu kì 3, nhóm IIA.
C. F, chu kì 2, nhóm VIIA. D. Ne, chu kì 2, nhóm VIIIA.
Phương pháp giải
Dựa vào dữ kiện đề bài cho tìm số hạt e, p của nguyên tố R. Từ đó biện luận vị trí của R trong bảng tuần hoàn
Lời giải chi tiết
E + P = (34 + 10):2 = 22 ® E=P=11
Đáp án A
II. TỰ LUẬN
Bài 1. Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn các nguyên tố hóa học và có tổng số đơn vị điện tích hạt nhân bằng 25.
a) Xác định số hiệu của X, Y.
b) Viết cấu hình electron nguyên tử X, Y và cho biết vị trí X, Y trong bảng tuần hoàn.
Lời giải chi tiết
a) Vì X và Y đứng kế tiếp nhau trong cùng 1 chu kỳ nên hạt nhân của chúng chỉ khác nhau 1 đơn vị. Giả sử ZX < ZY ta có ZY =ZX + 1
Theo đề bài, ta có : ZX + ZY = ZX + ZX + 1 = 25
\( \Rightarrow \)ZX = 12 (Mg) và ZY = 13 (Al)
b) Cấu hình electron của X: 1s22s22p63s2 ; ô thứ 12, nhóm IIA, chu kỳ 3
Cấu hình elctron của Y: 1s22s22p63s23p1 ; ô thứ 13, nhóm IIIA, chu kỳ 3
Bài 2. Hòa tan hoàn toàn 20 gam hỗn hợp 2 kim loại kiềm thổ A và B thuộc 2 chu kì liên tiếp vào dung dịch HCl dư thu được 15,68 lít khí (đktc). Xác định tên 2 kim loại kiềm thổ và thành phần % về khối lượng của mỗi kim loại trong hỗn hợp.
Lời giải chi tiết
Gọi R là kim loại trung bình của 2 kim loại A và B \( \Rightarrow \)R hóa trị II.
\({n_{{H_2}}} = 0,7mol\)
R + 2HCl RCl2 + H2; \({M_R} = \frac{{20}}{{0,7}} = 28,57\)
Dễ thấy 24 < 28,57 < 40 \( \Rightarrow \) A và B lần lượt là Mg và Ca
Gọi nMg = x mol; nCa = y mol \( \Rightarrow \)nhỗn hợp = x + y = 0,2 mol \(\left( 1 \right)\)
\(\left\{ {\begin{array}{*{20}{l}}{Mg{\rm{ }} + {\rm{ }}2HCl \to MgC{l_2} + {\rm{ }}{H_2}}\\{Ca{\rm{ }} + {\rm{ }}2HCl \to CaC{l_2} + {\rm{ }}{H_2}}\end{array}} \right. \Rightarrow {n_{{H_2}}} = x + y = 0,7\,\,\left( 2 \right)\)
Từ \(\left( 1 \right)\,\,v\`a \,\,\left( 2 \right) \Rightarrow \)x = 0,5; y = 0,2.
\(\% {m_{Mg}} = \frac{{0,5.24}}{{20}}.100\% = 60\% \Rightarrow \% {m_{Ca}} = 100\% - 60\% = 40\% .\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề thi giữa kì 1 Hóa 10 Kết nối tri thức - Đề số 6 timdapan.com"







