Đề kiểm tra 45 phút - Đề số 1 - Chương 5 - Hóa học 12
Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút - Đề số 1 - Chương 1 - Hóa học 12
Đề bài
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Hầu hết các kim loại đều có ánh kim là do
A. các electron tự do trong kim loại phản xạ những tia sáng nhìn thấy.
B. kim loại hấp thu được các tia sáng tới.
C. các kim loại đều ở thể rắn.
D. kim loại màu trắng bạc nên giữ được các tia sáng trên bề mặt kim loại.
Câu 2. Những kim loại nào sau đây có thể điều chế được từ oxit, bằng phương pháp nhiệt luyện nhờ chất khử \({H_2}\)?
A. Fe, Al, Cu.
B. Zn, Mg, Fe.
C. Fe, Mn, Ni.
D. Ni, Cu, Ca.
Câu 3. Thép dễ bị ăn mòn trong không khí ẩm. Cách nào sau đây không có tác dụng bảo vệ thép khỏi bị ăn mòn?
A. Hàn thêm một mẩu Sn vào thép.
B. Mạ một lớp kim loại như Zn, Cr lên bề mặt của thép.
C. Sơn một lớp mỏng.
D. Bôi một lớp dầu, mỡ (parafin) lên bề mặt của thép.
Câu 4. Cho dung dịch \(FeC{l_2}\) tác dụng với dung dịch \(AgN{O_3}\) dư, thu được phần không tan Z. Trong Z có chứa
A. Ag.
B. AgCl.
C. Ag, AgCl.
D. Ag, AgCl, Fe.
Câu 5. Điện phân 200 ml dung dịch chứa \(AgN{O_3}\) 0,2M và \(Cu{\left( {N{O_3}} \right)_2}\) 0,3M với dòng điện có cường độ 9,65A trong 10 phút. Điện cực trơ. Khối lượng kim loại bám trên catot là
A. 4,32 gam.
B. 5,6 gam.
C. 8,16 gam.
D. 4,96 gam.
Câu 6. Ngâm một đinh sắt sạch vào 100 ml dung dịch \(CuS{O_4}\) sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch, rửa sạch, làm khô thấy khối lượng đinh sắt tăng thêm 1,6 gam. Nồng độ mol của dung dịch \(CuS{O_4}\) ban đầu là
A. 0,25M.
B. 1 M.
C. 2 M.
D. 0,5 M.
II. PHẦN TỰ LUẬN (7 điểm).
Câu 1. (3 điểm)
a) Viết các phương trình phản ứng điều chế (trực tiếp hoặc gián tiếp) các kim loại sau từ các nguyên liêu tương ứng: \(BaC{O_3},Fe{\left( {OH} \right)_3},AgN{O_3}.\) Mỗi kim loại sử dụng một phương pháp riêng.
b) Nếu phương pháp hóa học tách riêng các kim loại từ hỗn hợp: Au, Cu, Fe.
Câu 2. (1 điểm). Viết các phương trình phản ứng sau:
\(\begin{array}{*{20}{l}}{a){\rm{ }}Fe + C{l_2}}\\{b)Zn + CuS{O_4}}\\{c)Al + F{e_3}{O_4}}\\{d)Na + {H_2}O}\end{array}\)
Câu 3. (3 điểm). Hỗn hợp A gồm 3 kim loại vụn nguyên chất Cu, Mg và Ba có khối lượng 10 gam.
+ Cho A tác dụng với dung dịch HCl dư, sau đó lọc lấy phần không tan riêng ra, rửa sạch đem nung trong không khí cho đến khi phản ứng hoàn toàn, sản phẩm thu được có khối lượng 8 gam.
+ Cho thêm để NaOH dư vào phần nước lọc, lấy kết tủa riêng ra, rửa sạch đem nung ở nhiệt độ cao đến khi khối lượng không đổi, sản phẩm thu được có khối lượng 4 ga,.
Tính khối lượng của từng kim loại trong hỗn hợp A.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Chọn A.
Câu 2. Chọn C.
\({H_2}\) có thể khử được các kim loại trừ \(Zn \to Cu.\)
Câu 3. Chọn A.
Vì Sn yếu hơn sắt, không bảo vệ được sắt.
C, D đúng vì đây là phương pháp cách li kim loại với môi trường.
B đúng: Phương pháp kết hợp: Cách li và dùng kim loại mạnh chịu ăn mòn thay.
Câu 4. Chọn C.
\(\begin{array}{l}F{e^{2 + }} + A{g^ + } \to Ag + F{e^{3 + }}\\C{l^ - } + A{g^ + } \to AgCl\end{array}\)
Câu 5. Chọn D.
\({t_{Ag}} = \dfrac{{{n_{Ag}}.1.F}}{I} = \dfrac{{0,04.96500}}{{9,65}} = 400s < 10\) phút
\( \to \) thời gian còn lại: 200s. Nếu \(Cu{(N{O_3})_2}\) dư
\(\begin{array}{l}{n_{Cu}} = \dfrac{{I.t}}{{2F}} = \dfrac{{9,65.200}}{{2.96500}} = 0,01mol < 0,03\\{n_A} = 0,04.108 + 0,01.64 = 4,96gam.\end{array}\)
Câu 6. Chọn C.
1 mol Fe tan tạo ra có 1 mol Cu bám vào \( \to \) mgiảm =64 – 56 = 8 gam.
Mà m giảm 1,6 gam \( \to \) nFe phản ứng = \({n_{CuS{O_4}}} = 0,2mol.\)
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (3 điểm)
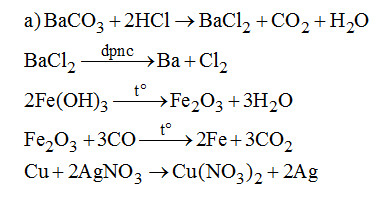
b) Cho hỗn hợp vào dung dịch HCl dư thu được dung dịch \(FeC{l_2}\) và hỗn hợp Au, Cu. Cho hỗn hợp vào dung dịch \(HN{O_3}\) loãng thu được dung dịch \(Cu{(N{O_3})_2}\) và còn lại Au. Điện phân các dung dịch để được các kim loai tương ứng.
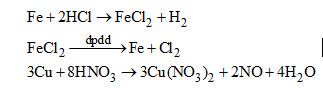
Câu 2. (1 điểm)
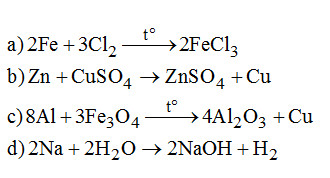
Câu 3. (3 điểm).
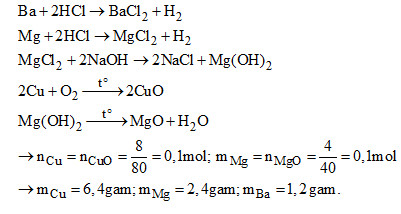
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề kiểm tra 45 phút - Đề số 1 - Chương 5 - Hóa học 12 timdapan.com"