Đề kiểm tra 15 phút - Đề số 2 - Chương VII - Hóa học 11
Đáp án và lời giải chi tiết Đề kiểm tra 15 phút - Đề số 2 - Chương VII - Hóa học 11
Đề bài
Câu 1. Đốt cháy hoàn toàn 39,6 gam hỗn hợp hai aren là đồng đẳng kế tiếp nhau thì cần 87,36 lít khí O2 (đktc). Xác định thể tích khí CO2 (đktc) tạo thành.
Câu 2. Cho một lượng CaC2 tác dụng với nước ta thu được 10 lít khí axetilen ở \(27,3^\circ C\) và p=2,464atm. Lấy \(\dfrac{1}{2}\) lượng khí sinh ra đi qua than đốt nóng (xúc tác) thì thu được hỗn hợp khí sản phẩm trong đó benzen chiếm 75% thể tích.
a) Tính hiệu suất phản ứng.
b) Làm lạnh khí sản phẩm tới nhiệt độ phòng thì thu được bao nhiêu ml chất lỏng, biết khối lượng riêng của chất lỏng là 0,8 g/ml?
Lời giải chi tiết
Câu 1.
Gọi công thức tương đương của hai aren là: \({C_{\overline n }}{H_{2\overline n - 6}}\)
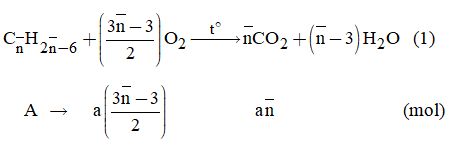
Theo đề bài, ta có hệ phương trình:
\(\left\{ \begin{array}{l}a\left( {14\overline n - 6} \right) = 39,6\\a\left( {\dfrac{{3\overline n - 3}}{2}} \right) = \dfrac{{87,36}}{{22,4}} = 3,9\end{array} \right. \)
\(\Rightarrow \left\{ \begin{array}{l}a\overline n = 3\\a = 0,4\end{array} \right.\)
Từ (1) \( \Rightarrow {n_{C{O_2}}} = a\overline n = 3\left( {mol} \right) \)
\(\Rightarrow {V_{C{O_2}}} = 3 \times 22,4 = 67,2\) (lít).
Câu 2.
Ta có: \({n_{{C_2}{H_2}}} = \dfrac{{pV}}{{RT}} \)\(\,= \dfrac{{2,464 \times 10}}{{0,082\left( {273 + 27,3} \right)}} = 1\left( {mol} \right)\)
Phản ứng: \(3CH \equiv CH \to {C_6}{H_6}({t^o} = 600{}^oC)\)
Như vậy hỗn hợp khí hơi gồm benzen và axetilen dư với tỉ lệ thể tích là 3 : 1.
a)Tính hiệu suất phản ứng:
Cách 1. Cứ 1 mol C6H6 tạo thành thì cần 3 mol C2H2 phản ứng. Do đó, nếu 3V C6H6 thì có 9V C2H2 phản ứng.
Nghĩa là: Cứ 10V C2H2 thì có 9V phản ứng và còn dư 1V.
Hiệu suất phản ứng:
\(H = \dfrac{{9 \times 100\% }}{{10}} = 90\% .\)
Cách 2. Theo thực tế thu được hỗn hợp gồm 3V C6H6 và 1V C2H2.
Nếu C2H2 còn lại cũng tạo thành C6H6 thì thu được thêm \(\dfrac{V}{3}\) C6H6.
Vậy tổng thể tích C6H6 thu được theo lí thuyết: \(3V + \dfrac{V}{3} = \dfrac{{10V}}{3}\)
Vậy hiệu suất phản ứng:
\(H = \dfrac{{3V}}{{\dfrac{{10V}}{3}}} \times 10\% = 90\% .\)
b) Thể tích chất lỏng thu được:
Từ (1) suy ra khối lượng C6H6 thu được bằng khối lượng C2H2 tham gia phản ứng.
\( \Rightarrow {m_{{C_6}{H_6}}} = \dfrac{1}{2} \times 26 \times \dfrac{{90}}{{100}} \)\(\,= 11,7\left( {gam} \right)\)
Mà: \({m_{{\rm{dd}}}} = V.d \)
\(\Rightarrow V = \dfrac{m}{d} = \dfrac{{11,7}}{{0,8}} = 14,625\left( {ml} \right).\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề kiểm tra 15 phút - Đề số 2 - Chương VII - Hóa học 11 timdapan.com"







