Đề kiểm tra 15 phút – Đề số 2 – Chương 8 – Hóa học 12
Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút – Đề số 2 – Chương 8 – Hóa học 12
Đề bài
Câu 1. Cách dễ dàng và an toàn nhất để nhận ra lọ đựng khí \({O_2}\) để cạnh các lọ chứa các khí \(C{l_2},N{O_2},N{H_3}\) là
A. quan sát màu sắc sau đó ngửi mùi.
B. ngửi mùi.
C. quan sát màu sắc.
D. ngửi mùi sau đó quan sát màu sắc.
Câu 2.
Giấy tẩm dung dịch \(CuS{O_4}\) đậm màu khi tiếp xúc với khí A và hóa đen khi tiế xúc với khí B. A, B lần lượt là
\(\begin{array}{l}A.\,N{O_2},\,C{l_2}.\\B.\,C{l_2},\,N{O_2}\\C.\,N{H_3},\,{H_2}\\D.\,{H_2}S,\,N{H_3}\end{array}\)
Câu 3. Thuốc thử nào sau đây không dùng để nhận ra sự có mặt của khí \(N{H_3}\) lẫn trong khí \({N_2}?\)
A. Giấy quỳ ẩm.
B. CuO nung nóng.
C. Khí HCl.
D. Dung dịch \({H_2}S{O_4}.\)
Câu 4. Khí \({N_2}O\) và khí \({O_2}\) đều duy trì sự chay vì \({N_2}O\) bị nhiệt phân dễ dàng sinh ra oxi nguyên tử. Hóa chất để phân biệt hai khí trên là
A. NO.
B. Mg.
C. tàn đóm đỏ.
D. \({N_2}\)
Câu 5. Cách phát hiện khí độc CO trong không khí là
A. quan sát màu sắc.
B. phát hiện mùi.
C. dùng nước vôi trong.
D. dùng dung dịch \(PdC{l_2}.\)
Câu 6. Phân biệt hai khí \(S{O_2}\) và \({C_2}{H_4}\) có thể dùng cách nào sau đây?
1. Dùng dung dịch \(KMn{O_4}\)
2. Dùng dung dịch nước vôi trong
A. 1.
B. 2.
C. 1, 2.
D. Cả 2 cách đều sai.
Câu 7. Hóa chất nào không dùng để phân biệt hai khí riêng biệt \(C{l_2}\) và \({O_3}?\)
A. Dung dịch \(AgN{O_3}\)
B. Lá đồng hơ nóng.
C. Dung dịch KI và hồ tinh bột.
D. Khí \(N{O_2}.\)
Câu 8. Trong thành phần của khí hóa lỏng làm nhiên liệu bắt buộc phải có thêm chất phụ gia có tác dụng cảnh báo nếu có rò rỉ. Chất phụ gia có
A. mùi thơm.
B. mùi khó chịu.
C. màu dễ nhận.
D. tính khử màu.
Câu 9. Thổi chậm 3,0 lít không khí (đktc) vào 50 ml dung dịch \(Ca{(OH)_2}\) 0,01M. Thêm phenolphtalein vào dung dịch thu được và nhỏ từ từ dung dịch HCl 0,01M đến khi dung dịch vừa hết màu hồng thì thể tích dung dịch HCl đã dùng là 40 ml. Phần trăm thể tích \(C{O_2}\) trong không khí đang phân tích là
A. 0,02.
B. 0,24.
C. 0,336.
D. 0,224.
Câu 10. Hỗn hợp khí \(S{O_2}\) và HCl sục vào dung dịch \(AgN{O_3}\) dư thu được 2,87 gam kết tủa. Cũng hỗn hợp ban đầu làm mất màu vừa đủ 100 ml dung dịch \(B{r_2}\) 0,1M. Phần trăm thể tích của \(S{O_2}\) là
A. 33,33%.
B. 66,67%.
C. 50%.
D. 40%.
Lời giải chi tiết
Câu 1. Chọn A.
\(C{l_2}\) và \(N{O_2}\) là các khí độc và có màu.
\(N{H_3}\) ít độc, không màu mùi khai.
Câu 2. Chọn C.
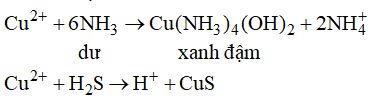
Câu 3. Chọn D.
\(2N{H_3} + {H_2}S{O_4} \to {(N{H_4})_2}S{O_4}\) (không có hiện tượng gì)
Câu 4. Chọn A.
\(NO + {O_2} \to N{O_2}\) (nâu) phản ứng xảy ra ở nhiệt độ thường.
Câu 5. Chọn D.
Dùng phương pháp loại trừ: CO không màu, không mùi, không phản ứng với \(Ca{(OH)_2}.\)
\(CO + PdC{l_2} + {H_2}O \to Pd \downarrow + 2HCl + C{O_2}\)
Câu 6. Chọn C.
\(S{O_2}\) làm đục nước vôi trong (\(CaS{O_3}\) kết tủa)
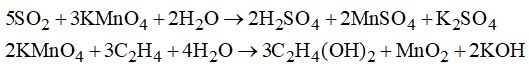
Câu 7. Chọn C.
Câu 8. Chọn B.
Mùi khó chịu có tác dụng báo hiệu khi ga rò, còn mùi thơm nếu người không biết (nhất là trẻ em) sẽ thích ngửi, gây ngộ độc.
Câu 9. Chọn D.
\(\begin{array}{l}C{O_2} + Ca{(OH)_2} \to CaC{O_3} + {H_2}O\\2HCl + Ca{(OH)_2} \to CaC{l_2} + 2{H_2}O\\{n_{C{O_2}}} + 2{n_{HCl}} = {n_{Ca{{(OH)}_2}}}\\ \to {n_{C{O_2}}} = 0,0005 - 0,0004.\dfrac{1}{2} = 0,0003mol\\ \to \% {V_{C{O_2}}} = \dfrac{{0,0003.22,4}}{3}.100\% = 0.224\% .\end{array}\)
Câu 10. Chọn A.
\(5S{O_2} + B{r_2} + 2{H_2}O \to 2{H_2}S{O_4} + 2HBr\)
0,01 0,01 mol
\(HCl + AgN{O_3} \to AgCl + HN{O_3}\)
0,02mol 0,02 mol
\( \to S{O_2}\) chiếm 33,33%
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề kiểm tra 15 phút – Đề số 2 – Chương 8 – Hóa học 12 timdapan.com"