Bài 7 trang 101 SGK Hoá học 9
Giải bài 7 trang 101 SGK Hoá học 9. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
Đề bài
a) Hãy xác định công thức của hợp chất khí A, biết rằng:
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thể tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Phương pháp giải - Xem chi tiết
Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
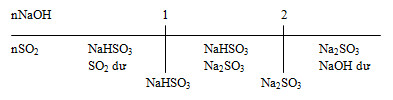
Đặt \(a = \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}}\)
+ a ≤ 1: Chỉ tạo muối NaHSO3.
+ 1 ≤ a ≤ 2: Tạo 2 muối NaHSO3 và Na2SO3
+ a ≥ 2: Chỉ tạo muối Na2SO3.
Lời giải chi tiết
nA = \( \dfrac{0,35}{22,4}\) = 0,015625 mol.
MA = \( \dfrac{1}{0,015625}\) = 64g
Đặt công thức phân tử của A là SxOy
Lập tỷ số về khối lượng để tính các chỉ số x và y
\(x.\dfrac{{32}}{{64}} = \dfrac{{50}}{{100}} \to x = 1\)
\(y.\dfrac{{16}}{{64}} = \dfrac{{50}}{{100}} \to y = 2\)
Vậy công thức phân tử của A là SO2
b. \({n_{S{O_2}}} = \dfrac{{12,8}}{{64}} = 0,2\,\,mol\)
Đổi 300 ml = 0,3 lít
\({n_{NaOH}} = 1,2.0,3 = 0,36\,\,mol\)
Ta thấy \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = \dfrac{{0,36}}{{0,2}} = 1,8 < 2 \to \)Phản ứng tạo 2 muối Na2SO3 và NaHSO3
Phương trình phản ứng:
\(S{O_2} + NaOH \to NaH{\rm{S}}{O_3}\)(1)
x x x
\(S{O_2} + 2NaOH \to N{a_2}S{O_3} + {H_2}O\)(2)
y 2y y
Gọi \({n_{NaH{\rm{S}}{O_3}}} = x\,\,(mol);{n_{N{a_2}S{O_3}}} = y\,\,(mol)\)
Theo phương trình (1) và (2): \({n_{S{O_2}}} = {n_{NaH{\rm{S}}{O_3}}} + {n_{N{a_2}S{O_3}}} \to x + y = 0,2\)(*)
Theo phương trình (1) và (2): \({n_{NaOH}} = {n_{NaH{\rm{S}}{O_3}}} + 2{n_{N{a_2}S{O_3}}} \to x + 2y = 0,36\)(**)
Từ (*) và (**) \( \to\) x = 0,04; y = 0,16
\({C_{M(NaH{\rm{S}}{O_3})}} = \dfrac{{0,04}}{{0,3}} = 0,13M\)
\({C_{M(N{a_2}S{O_3})}} = \dfrac{{0,16}}{{0,3}} = 0,53M\)
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 7 trang 101 SGK Hoá học 9 timdapan.com"







