Bài 2. Nguyên tử trang 12, 13, 14 Vở thực thành khoa học tự nhiên 7
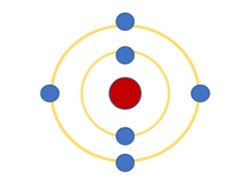
Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào? Hãy quan sát Hình 2.3 SGK KHTN 7 và trả lời câu hỏi: 1. Các đường tròn bằng giấy màu vàng biểu diễn gì? 2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron.
2.1
Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào?
Phương pháp giải:
Dựa vào
- Theo Đê – mô – crit: sự tồn tại của một loại hạt vô cùng nhỏ (được gọi là nguyên tử) tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được”.
- Theo Đan – tơn: Khi tiến hành các thí nghiệm hóa học, ông nhận thấy các chất tác dụng vừa đủ với nhau theo các lượng xác định. Điều đó chứng tỏ rằng có các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
Lời giải chi tiết:
- Theo Đê – mô – crit: Nguyên tử là loại hạt vô cùng nhỏ “không thể phân chia được nữa”.
- Theo Đan – tơn: Nguyên tử là các “đơn vị chất tối thiểu” để các chất tác dụng vừa đủ với nhau theo các lượng xác định.
2.2
Hãy quan sát Hình 2.3 SGK KHTN 7 và trả lời câu hỏi:
1. Các đường tròn bằng giấy màu vàng biểu diễn gì?
2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron.
Phương pháp giải:
Dựa vào
1. Nguyên tử gồm 2 phần: lớp vỏ và hạt nhân.
2.
- Nguyên tử carbon có 6 electron.
- Lớp thứ nhất chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất.
- Lớp thứ 2 chứa tối đa 4 electron
Lời giải chi tiết:
1.
Các đường tròn bằng giấy màu vàng biểu diễn lớp electron của nguyên tử.
2.
- Quan sát mô hình nguyên tử carbon, nhận thấy:
+ Lớp thứ nhất: chứa 2 electron.
+ Lớp thứ hai: chứa 4 electron
→Lớp thứ nhất đã chứa tối đa electron (2 electron).
2.3
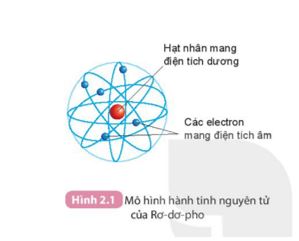
Quan sát Hình 2.1 SGK KHTN 7 và cho biết các thành phần cấu tạo nên nguyên tử.
Phương pháp giải:
Dựa vào
Dựa vào Hình 2.1, nguyên tử được cấu tạo từ hạt nhân mang điện tích dương và các electron mang điện tích âm.
Lời giải chi tiết:
Quan sát hình 2.1, thành phần cấu tạo nên nguyên tử gồm:
+ Hạt nhân nằm ở tâm, mang điện tích dương.
+ Các electron mang điện tích âm, chuyển động xung quanh hạt nhân.
2.4
Quan sát Hình 2.2 SGK KHTN 7, áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo của nguyên tử hydrogen và nguyên tử carbon.
Phương pháp giải:
Dựa vào
- Nguyên tử hydrogen: Hạt nhân mang điện tích dương, chỉ có 1 lớp electron và chứa 1 electron.
- Nguyên tử carbon: Hạt nhân mang điện tích dương, có 2 lớp electron và có tổng 6 electron.
Lời giải chi tiết:
Áp dụng mô hình nguyên tử của Bo
- Nguyên tử hydrogen:
+ Hạt nhân nằm ở tâm, mang điện tích dương.
+ Có 1 electron (mang điện tích âm) nằm ở lớp thứ nhất, quay xung quanh hạt nhân.
- Nguyên tử carbon:
+ Hạt nhân nằm ở tâm, mang điện tích dương.
+ Có 2 lớp electron và 6 electron phân bố ở các lớp: lớp thứ nhất có 2 electron, lớp thứ 2 có 4 electron. Các electron quay xung quanh hạt nhân.
2.5
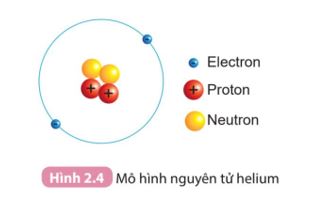
Quan sát Hình 2.4 SGK KHTN 7 và cho biết:
1. Hạt nhân nguyên tử có một hay nhiều hạt?
Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Phương pháp giải:
Dựa vào
1. Quan sát Hình 2.4 có thể thấy rằng: hạt nhân bao gồm nhiều hạt, các hạt đó thuộc nhiều loại hạt.
2. Số đơn vị điện tích hạt nhân bằng tổng số hạt proton có trong hạt nhân.
Lời giải chi tiết:
1.
Quan sát Hình 2.4:
- Hạt nhân nguyên tử gồm nhiều hạt: 2 hạt proton và 2 hạt neutron.
- Các hạt đó thuộc nhiều loại hạt, đó là: proton (màu đỏ), neutron (màu vàng).
2.
- Số đơn vị điện tích hạt nhân (Z) bằng tổng số hạt proton trong hạt nhân.
- Trong Hình 2.4, Helium có 2 proton (hạt màu đỏ).
2.6
Quan sát các mô hình nguyên tử ở Hình 2.5 SGK KHTN 7 và hoàn thành bảng sau:
|
Nguyên tử |
Số proton trong hạt nhân |
Số electron trong vỏ nguyên tử |
Số lớp electron |
Số electron ở lớp electron ngoài cùng |
|
Carbon |
|
|
|
|
|
Oxygen |
|
|
|
|
|
Nitrogen |
|
|
|
|
Phương pháp giải:
Dựa vào
- Proton mang điện tích dương, nằm ở trong hạt nhân.
- Electron mang điện tích âm, sắp xếp thành từng lớp.
- Số lớp electron = số đường tròn bao quanh hạt nhân.
- Số electron ở lớp electron ngoài cùng = số quả cầu ở đường tròn ngoài cùng.
Lời giải chi tiết:
|
Nguyên tử |
Số proton trong hạt nhân |
Số electron trong vỏ nguyên tử |
Số lớp electron |
Số electron ở lớp electron ngoài cùng |
|
Carbon |
6 |
6 |
2 |
4 |
|
Oxygen |
8 |
8 |
2 |
6 |
|
Nitrogen |
7 |
7 |
2 |
5 |
2.7
Quan sát Hình 2.6 và cho biết:
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine.
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine.
Phương pháp giải:
Dựa vào
1. Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine là số quả cầu trên các đường tròn.
Lời giải chi tiết:
1.
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3.
2.
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba có 7 electron.
2.8
Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
Phương pháp giải:
Dựa vào
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân và các hạt electron ở vỏ nguyên tử.
- Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron.
Lời giải chi tiết:
- Ta có:
+ Khối lượng 1 proton = 1 neutron = 1amu.
+ Khối lượng 1 electron = 0,00055 amu.
2.9
Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n).
Phương pháp giải:
Dựa vào
Khối lượng 1 proton = 1 neutron = 1amu.
Khối lượng 1 electron = 0,00055 amu.
Lời giải chi tiết:
- Biết rằng khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
- Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân.
- Mà: Khối lượng 1 proton = 1 neutron = 1amu.
2.10
Căn cứ khối lượng nguyên tử nhôm, hãy xác định tỉ lệ giữa khối lượng hạt nhân và tổng khối lượng các electron và cho nhận xét.
Phương pháp giải:
Dựa vào
mp = mn = 1u.
me = 0, 00055u
2.11
Hạt nhân mang điện tích dương, các electron mang điện tích âm. Tại sao chúng không bị hút chặt vào nhau mà electron vẫn chuyển động xung quanh hạt nhân?
Phương pháp giải:
Dựa vào
Tìm hiểu thông tin trên sách báo, Internet, liên kết các thông tin và vấn đề.
Lời giải chi tiết:
Các đám mây electron có thể tích càng nhỏ, động năng của electron càng cao và để bảo toàn năng lượng thế năng của nguyên tử sẽ giảm đi.
Do đó “động năng chính là rào cản ngăn không cho các electron bị hút vào hạt nhân nguyên tử” và ngược lại khi thể tích đám mây tăng lên, thế năng của nguyên tử cũng tăng lên, lúc này nó trở thành năng lượng kéo giữ chân các electron không bị bay ra ngoài nguyên tử. Vì vậy, các electron chuyển động xung quanh hạt nhân giống như một đám mây xác suất.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 2. Nguyên tử trang 12, 13, 14 Vở thực thành khoa học tự nhiên 7 timdapan.com"