Giải đề thi học kì 1 hoá lớp 12 năm 2019 - 2020 sở giáo dục và đào tạo Đà Nẵng
Giải chi tiết đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục và đào tạo Đà Nẵng với cách giải nhanh và chú ý quan trọng
Câu 1: Este có công thức cấu tạo: CH2=CHCOOC2H5 có tên gọi là
A. etyl propionat
B. etyl axetat
C. vinyl acrylat
D. etyl acrylat
Câu 2: Chất nào sau đây được dùng trong y học để chế tạo “xi măng sinh học”, làm răng giả?
A. poli (metyl metacrylat)
B. poli (metyl acrylat)
C. poli (vinyl clorua)
D. polistiren
Câu 3: Chất nào sau đây thuộc loại amin đơn chức bậc hai?
A. CH3NH2 B. (CH3)2NH
C. (CH3)3N D. H2NCH2CH2NH2
Câu 4: Trong các kim loại: Al, Cu, Fe và Ag. Kim loại có tính dẫn điện cao nhất là
A. Cu B. Fe
C. Ag D. Al
Câu 5: Cacbohiđrat nào sau đây thủy phân trong môi trường axit thu được 2 sản phẩm?
A. tinh bột B. saccarozơ
C. fructozơ D. xenlulozơ
Câu 6: α-amino axit nào sau đây làm quỳ tím hóa xanh?
A. H2NCH2COOH
B. H2NCH2CH2CH(NH2)COOH
C. H2NCH2CH(NH2)CH2COOH
D. Cả B và C đều đúng
Câu 7: Với lượng dư dung dịch nào sau đây tác dụng với kim loại sắt không tạo thành muối sắt (III)?
A. HCl đặc, nóng B. H2SO4 đặc, nóng
C. HNO3 loãng D. AgNO3
Câu 8: Cho các dung dịch: glixerol, abumin, saccarozơ, glucozơ. Số dung dịch phản ứng với Cu(OH)2 trong môi trường kiềm là
A. 4 B. 3
C. 1 D. 2
Câu 9: Công thức phân tử của axit 2,6 – điaminohexanoic là
A. C5H9O4N
B. C5H11O2N
C. C6H13O2N
D. C6H14O2N2
Câu 10: Chất hữu cơ X (chứa vòng benzen) có công thức là CH3COOCH2C6H4OH. Khi đun nóng, a mol X tác dụng được với tối đa bao nhiêu mol NaOH trong dung dịch?
A. a mol
B. 2a mol
C. 3a mol
D. 4a mol
Câu 11: Thủy phân hoàn toàn 1 mol pentapeptit X, thu được 2 mol Gly, 2 mol Ala và 1 mol Val. Nếu thủy phân không hoàn toàn X thì thu được hỗn hợp sản phẩm trong đó có Ala-Gly-Ala, Gly-Val, nhưng không có Val-Ala. Amino axit ở đầu X và đầu N trong X tương ứng là
A. Val và Ala
B. Gly và Val
C. Ala và Val
D. Ala và Gly
Câu 12: Phản ứng nào sau đây là phản ứng điều chế kim loại theo phương pháp thủy luyện?
A. Mg + FeSO4 \( \to\) MgSO4 + Fe
B. CuCl2 \( \to\) Cu + Cl2
C. CO + CuO \( \to\) Cu + CO2
D. 2Al2O3 \( \to\) 4Al + 3O2
Câu 13: Lòng trắng trứng là chất dịch không màu hoặc màu trắng ngà bên trong một quả trứng (trứng gà, trứng vịt). Lòng trắng trứng là nguồn thực phẩm giàu protein, bị đông tụ khi đun nóng hoặc tác dụng với axit, bazơ và một số muối. Lòng trắng trứng chứa loại protein nào sau đây
A. abumin
B. fibroin
C. hemoglobin
D. plasma
Câu 14: Thể tích khí H2 (đktc) cần dùng để tác dụng vừa đủ với 0,1 mol triolein là
A. 0 lít
B. 13,44 lít
C. 3,36 lít
D. 6,72 lít
Câu 15: Cho m gam hỗn hợp X gồm axit fomic và metyl fomat (có tỷ lệ mol 1:1) tác dụng với lượng dư AgNO3 trong môi trường NH3, thu được 43,2 gam kim loại Ag. Phần trăm khối lượng của metyl fomat có trong hỗn hợp X là
A. 56,6%
B. 43,4%
C. 50%
D. 39,47%
Câu 16: Đốt cháy hoàn toàn m gam hỗn hợp gồm Cu, Fe cần vừa đủ 4,48 lít khí Cl2 (đktc), thu được 23 gam hỗn hợp muối. Giá trị của m là
A. 12 B. 8,8
C. 6,0 D. 12,35
Câu 17: Polime nào sau đây không được tổng hợp bằng phản ứng trùng ngưng?
A. tơ capron
B. poli (etilen terephtalat)
C. tơ nitron
D. poli (hexametylen ađipamit)
Câu 18: Đốt cháy hoàn toàn amin đơn chức X, thu được 4,48 lít CO2 (đktc); 6,3 gam H2O và 1,12 lít N2 (đktc). Công thức phân tử của X là
A. CH5N B. C2H5N
C. C2H7N D. C3H9N
Câu 19: Đốt cháy hoàn toàn 13,728 gam triglixerit X, thu được a mol hỗn hợp Y gồm CO2 và H2O. Cho toàn bộ hỗn hợp Y qua cacbon nung đỏ, thu được 2,364 mol hỗn hợp Z gồm CO, H2 và CO2. Cho hỗn hợp Z qua dung dịch Ba(OH)2 dư thu được 202,516 gam kết tủa. Cho 13,728 gam X tác dụng được tối đa với 0,032 mol Br2 trong dung dịch. Giá trị của m là
A. 14,648 B. 14,784
C. 14,176 D. 14,624
Câu 20: Cho m gam bột sắt vào dung dịch HNO3, sau khi phản ứng hoàn toàn, thu được 2,24 lít khí NO (sản phẩm khử duy nhất của N+5 ở đktc) và 2,4 gam chất rắn. Giá trị của m là
A. 8,0 B. 5,6
C. 8,4 D. 10,8
Câu 21: Cho các sơ đồ phản ứng sau:
X (C8H14O4) + 2NaOH \( \to\) X1 + X2 + H2O
X1 + H2SO4 \( \to\) X3 + Na2SO4
nX5 + nX3 \( \to\) poli (hexametylen ađipamit) + 2nH2O
Phân tử khối của X6 là
A. 136 B. 194
C. 184 D. 202
Câu 22: Kết quả thí nghiệm của các chất X, Y, Z với các thuốc thử được ghi ở bảng sau:
|
Chất |
Thuốc thử |
Hiện tượng |
|
X |
Cu(OH)2 |
Tạo hợp chất màu tím |
|
Y |
Dung dịch AgNO3 trong NH3 |
Tạo kết tủa Ag |
|
Z |
Nước brom |
Tạo kết tủa trắng |
Các chất X, Y, Z lần lượt là
A. Gly-Ala-Gly, etyl fomat, anilin
B. Gly-Ala-Gly, anilin, etyl fomat
C. Etyl fomat, Gly-Ala-Gly, anilin
D. Anilin, Etyl fomat, Gly-Ala-Gly
Câu 23: Cho hỗn hợp X gồm Gly, Ala, Val và Glu. Để tác dụng hết với 0,2 mol X cần 100 ml dung dịch chứa hỗn hợp gồm NaOH 1M và KOH 1,4M. Đốt cháy hoàn toàn 0,2 mol X cần V lít O2 (đktc), hấp thụ sản phẩm cháy vào dung dịch NaOH dư, khối lượng dung dịch sau phản ứng tăng 56,88 gam. Giá trị của V là
A. 25,760 B. 22,848
C. 26,432 D. 25,536
Câu 24: Ancol etylic được điều chế bằng cách lên men tinh bột theo sơ đồ sau:
(C6H10O5)n \( \to\) C6H12O6 \( \to\) C2H5OH
Để điều chế 10 lít ancol etylic 46o cần m kg gạo (chứa 75% tinh bột, còn lại là tạp chất). Biết hiệu suất của cả quá trình là 80% và khối lượng riêng của ancol etylic nguyên chất là 0,8 g/ml. Giá trị của m là
A. 3,600 B. 6,912
C. 10,800 D. 8,100.
Câu 25: Thí nghiệm điều chế và thử tính chất của khí X được thực hiện như hình vẽ:
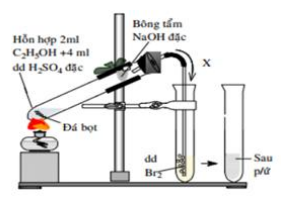
Cho các phát biểu sau về thí nghiệm trên:
(a) Đá bọt có tác dụng không cho chất lỏng trào lên trên
(b) Dung dịch NaOH có tác dụng hấp thụ khí SO2
(c) Dung dịch Br2 bị nhạt màu dần
(d) Khí X đi vào dung dịch Br2 là C2H2
(e) Nếu thay dung dịch Br2 thành dung dịch KMnO4 thì sẽ có kết tủa.
(g) Nên hơ đều bình cầu rồi sau đó mới đun tập trung.
Số phát biểu đúng là
A. 3 B. 4
C. 5 D. 6
Câu 26: Cho các phát biểu sau:
(a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
(b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông.
(c) Glucozơ có vị ngọt thấy đầu lưỡi mát lạnh do xảy ra phản ứng lên men rượu
(d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím
(e) Nicotin là một amin độc, có trong thuốc lá
(f) Sau khi lưu hóa, cao su chịu nhiệt và đàn hồi tốt hơn.
Số phát biểu đúng là
A. 6 B. 4
C. 5 D. 3
Câu 27: Hợp chất hữu cơ X (C8H15O4N) tác dụng với dung dịch NaOH dư, đun nóng, thu được sản phẩm hữu cơ gồm muối đinatri glutamat và ancol. Số công thức cấu tạo của X là
A. 6 B. 5
C. 4 D. 3
Câu 28: Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau mọt thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 loãng dư. Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
A. 58,52% B. 51,85%
C. 48,15% D. 41,48%
Câu 29: Hỗn hợp X gồm ba este đơn chức được tạo thành từ một ancol Y với ba axit cacboxylic, trong đó có hai axit là đồng đẳng kế tiếp nhau và một axit không no (có đồng phân hình học và có hai liên kết π trong phân tử). Thủy phân hoàn toàn 5,88 gam X bằng dung dịch NaOH thu được hỗn hợp muối và m gam ancol Y. Cho m gam Y vào bình đựng Na dư, sau phản ứng thu được 896 ml khí (đktc) và khối lượng bình tăng 2,48 gam so với ban đầu. Mặt khác, đốt cháy hoàn toàn 5,88 gam X, thu được 3,96 gam H2O. Phần trăm khối lượng của este không no trong X có giá trị gần nhất với giá trị nào sau đây?
A. 29 B. 30
C. 35 D. 34
Câu 30: Cho hỗn hợp gồm hai muối có công thức C4H14O3N2 và C5H14O4N2 tác dụng với dung dịch NaOH vừa đủ (đun nóng) thu được m gam hỗn hợp X gồm hai muối Y, Z (Y là chất vô xơ, MY < MZ) và 2,24 lít (đktc) hỗn hợp E gồm hai amin no, đơn chức, kế tiếp trong dãy đồng đẳng. Tỷ khối của E so với H2 là 16,9. Khối lượng của muối Z trong X là
A. 2,12 gam B. 3,18 gam
C. 4,02 gam D. 4,44 gam
ĐÁP ÁN
|
1D |
2A |
3B |
4C |
5B |
6B |
7A |
8A |
9D |
10B |
|
11A |
12A |
13A |
14D |
15A |
16B |
17C |
18C |
19C |
20D |
|
21D |
22A |
23D |
24C |
25C |
26C |
27A |
28B |
29D |
30D |
HƯỚNG DẪN GIẢI CHI TIẾT
Thực hiện: Ban chuyên môn
Câu 1 (TH):
Phương pháp:
Cho este R-COO-R’
- Nếu gốc ancol là đơn chức: Tên este = tên gốc hiđrocacbon R’ + tên gốc axit (“ic” ® “at”)
- Nếu gốc ancol là đa chức: Tên este = tên ancol + tên gốc axit (“ic” ® “at”)
Cách giải:
Este CH2=CHCOOC2H5 có tên gọi là etyl acrylat
Chọn D.
Câu 2 (NB):
Phương pháp:
Plexiglas có những tính chất ưu việt nên được dùng làm kính máy bay, ô tô, kính trong các máy móc nghiên cứu, kính xây dựng, đồ dùng gia đình, trong y học (dùng làm răng giả, xương giả), kính bảo hiểm,…
Cách giải:
Poli (metyl metacrylat) (thủy tinh hữu cơ plexiglas) được ứng dụng trong y học để chế tạo “xi măng sinh học”, làm răng giả.
Chọn A.
Câu 3 (TH):
Phương pháp:
Bậc của amin được tính bằng số nguyên tử H trong phân tử NH3 được thay thế bằng gốc hiđrocacbon. Theo đó các amin được phân loại thành: amin bậc I, amin bậc II và amin bậc III
Cách giải:
CH3NH2 và H2NCH2CH2NH2 là amin bậc I
(CH3)2NH là amin bậc II
(CH3)3N là amin bậc III
Chọn B.
Câu 4 (NB):
Phương pháp:
Các kim loại dẫn điện tốt nhất theo thứ tự giảm dần: Ag, Cu, Au, Al, Fe,…
Cách giải:
Kim loại có tính dẫn điện cao nhất là Ag
Chọn C.
Câu 5 (TH):
Phương pháp:
Saccarozơ thủy phân khi có mặt axit xúc tác sinh ra 1 phân tử glucozơ và 1 phân tử fructozơ
Mantozơ thủy phân khi có mặt axit xúc tác sinh ra 2 phân tử glucozơ
Tinh bột và xenlulozơ thủy phân hoàn toàn khi có mặt axit xúc tác sinh ra các phân tử glucozơ
Cách giải:
Tinh bột và xenlulozơ thủy phân hoàn toàn khi có mặt axit xúc tác sinh ra các phân tử glucozơ
Saccarozơ thủy phân khi có mặt axit xúc tác sinh ra 1 phân tử glucozơ và 1 phân tử fructozơ
Fructozơ không bị thủy phân
Chọn B.
Câu 6 (TH):
Phương pháp:
Hợp chất có dạng (NH2)xR(COOH)y
+ Nếu x < y ® dung dịch có môi trường axit ® quỳ tím chuyển đỏ
+ Nếu x > y ® dung dịch có môi trường bazơ ® quỳ tím chuyển xanh
+ Nếu x = y ® dung dịch có môi trường trung tính ® không đổi màu quỳ tím
Cách giải:
H2NCH2COOH không làm đổi màu quỳ tím
H2NCH2CH2CH(NH2)COOH và H2NCH2CH(NH2)CH2COOH làm quỳ tím chuyển sang màu xanh
Chọn B.
Câu 7 (TH):
Phương pháp:
Viết phương trình hóa học và kết luận.
Cách giải:
\(F{\rm{e}} + 2HCl \to F{\rm{e}}C{l_2} + {H_2}\)
\(2F{\text{e}} + 6{H_2}S{O_{4\,\,dac}}\xrightarrow{{{t^0}}}F{{\text{e}}_2}{(S{O_4})_3} + 3S{O_2} + 6{H_2}O\)
\(F{\rm{e}} + 4HN{O_3} \to F{\rm{e}}{(N{O_3})_3} + NO + 2{H_2}O\)
\(F{\rm{e}} + 3AgN{O_{3\,\,du}} \to F{\rm{e}}{(N{O_3})_3} + 3Ag\)
Chọn A.
Câu 8 (TH):
Phương pháp:
Các chất có khả năng phản ứng với Cu(OH)2 trong môi trường kiềm
+ Tripeptit trở lên
+ Protein
+ Các chất có nhóm OH- kề nhau
+ Có nhóm chức CHO trong phân tử
Cách giải:
Abumin là phản ứng màu biure thu được dung dịch có màu xanh tím
Glixerol, saccarozơ, glucozơ tạo phức xanh do phân tử có nhiều nhóm OH- kề nhau.
Chọn A.
Câu 9 (TH):
Phương pháp:
- Viết công thức cấu tạo
- Kết luận công thức phân tử
Cách giải:
2,6-điaminohexanoic có công thức cấu tạo H2NCH2CH2CH2CH2CH(NH2)COOH
\( \to\) CTPT: C6H14N2O2
Chọn D.
Câu 10 (TH):
Phương pháp:
- Viết PTHH
- Kết luận
Cách giải:
\(C{H_3}COOC{H_2}{C_6}{H_4}OH + 2NaOH \to C{H_3}COON{\rm{a}} + HO{C_6}{H_4}ONa + {H_2}O\)
Vậy nNaOH = 2nX = 2a (mol)
Chọn B.
Câu 11 (VD):
Phương pháp:
- Xác định số lượng các mắt xích có trong X
- Xác định thứ tự các mắt xích trong X
- Kết luận.
Cách giải:
X có dạng (Gly)2(Ala)2(Val)
Trong X có các đoạn Ala-Gly-Ala, Gly-Val nhưng không có đoạn Val-Ala
\( \to\) X là Ala-Gly-Ala-Gly-Val
\( \to\) Amino axit đầu C và đầu N lần lượt là Val và Ala
Chọn A.
Câu 12 (TH):
Phương pháp:
Cơ sở của phương pháp thủy luyện: Dùng những dung dịch thích hợp để hòa tan kim loại hoặc hợp chất của kim loại và tách ra phần không tan. Sau đó dùng các kim loại mạnh hơn (như Mg, Al) để khử ion kim loại thành kim loại cần điều chế.
Cách giải:
Đáp án A điều chế kim loại bằng phương pháp thủy luyện
Đáp án B, D điều chế kim loại bằng phương pháp điện phân
Đáp án C điều chế kim loại bằng phương pháp nhiệt luyện
Chọn A.
Câu 13 (TH):
Phương pháp:
Lòng trắng trứng chứa protein là abumin.
Cách giải:
Abumin có trong lòng trắng trứng
Chọn A.
Câu 14 (VD):
Phương pháp:
- Viết PTHH
- Tính số mol H2
- Tính thể tích H2
Cách giải:
PTHH: \({({C_{17}}{H_{33}}COO)_3}{C_3}{H_5} + 3{H_2} \to {({C_{17}}{H_{35}}COO)_3}{C_3}{H_5}\)
Theo phương trình hóa học: \({n_{{H_2}}} = 3{n_{tri{\rm{o}}lin}} = 3.0,1 = 0,3\,\,mol\)
\( \to {V_{{H_2}}} = 0,3.22,4 = 6,72\,\,lit\)
Chọn D.
Câu 15 (VD):
Phương pháp:
- Giả sử số mol các chất ban đầu là 1 mol
- Tính % khối lượng các chất trong hỗn hợp X.
Cách giải:
Giả sử số mol của axit fomic và metyl fomat đều là 1 mol
\( \to \% {m_{metyl\,\,f{\rm{o}}mat}} = \dfrac{{60.1}}{{46.1 + 60.1}}.100\% = 56,6\% \)
Chọn A.
Câu 16 (VD):
Phương pháp:
- Tính số mol và khối lượng của khí Cl2
- Áp dụng bảo toàn khối lượng tìm m.
Cách giải:
\({n_{C{l_2}}} = \dfrac{{4,48}}{{22,4}} = 0,2\,\,mol \to {m_{C{l_2}}} = 0,2.71 = 14,2\,\,gam\)
Áp dụng bảo toàn khối lượng: mFe + mCu + mCl2 = mmuối
\( \to\) m + 14,2 = 23 \( \to\) m = 8,8
Chọn B.
Câu 17 (TH):
Phương pháp:
- Trùng hợp là quá trình kết hợp nhiều phân tử nhỏ (monome), giống nhau hay tương tự nhau thành phân tử rất lớn (polime)
- Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác (như H2O…)
Cách giải:
Tơ nitron không được tổng hợp bằng phản ứng trùng ngưng
\(nC{H_2} = CHCN\xrightarrow{{xt,{t^0},p}}{( - C{H_2} - CHCN - )_n}\)
Chọn C.
Câu 18 (VD):
Phương pháp:
- Tính số mol CO2, H2O và N2
- Bảo toàn N để tìm số mol X
- Tìm số C
- Tìm số H
- Kết luận.
Cách giải:
\({n_{C{O_2}}} = \dfrac{{4,48}}{{22,4}} = 0,2\,\,mol;{n_{{H_2}O}} = \dfrac{{6,3}}{{18}} = 0,35\,\,mol\)
\({n_{{N_2}}} = \dfrac{{1,12}}{{22,4}} = 0,05\,\,mol\)
Bảo toàn nguyên tố N: \({n_X} = 2{n_{{N_2}}} = 2.0,05 = 0,1\,\,mol\)
Số C = \(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,2}}{{0,1}} = 2\)
Số H = \(\dfrac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{2.0,35}}{{0,1}} = 7\)
Vậy X là C2H7N.
Chọn C.
Câu 19 (VD):
Phương pháp:
- Tính số mol CO2 từ số mol kết tủa
- Suy ra tổng số mol CO và H2
- Áp dụng bảo toàn electron, tìm số mol C
- Suy ra giá trị của a.
- Quy đổi hỗn hợp X thành (HCOO)3C3H5, CH2 và H2O
- Lập phương trình khối lượng X (1)
- Lập phương trình giá trị của a (2)
- Từ (1) và (2) tìm ra số mol (HCOO)3C3H5 và CH2
- Tìm số mol NaOH và glixerol.
- Bảo toàn khối lượng để tìm khối lượng muối
Cách giải:
Dẫn hỗn hợp Z qua dung dịch Ba(OH)2 dư thì \({n_{C{O_2}}} = {n_{BaC{{\rm{O}}_3}}} = 1,028\,\,mol\)
\( \to {n_{CO}} + {n_{{H_2}}} = 2,364 - 1,028 = 1,336\)mol
Xét quá trình trao đổi electron của phản ứng giữa C với CO2 và H2O
C \( \to\) C+4 + 4e C+4 + 2e \( \to\) C+2
2H+ + 2e \( \to\) H2
Áp dụng bảo toàn electron: \(4{n_C} = 2{n_{CO}} + 2{n_{{H_2}}}\)
\( \to {n_C} = \dfrac{{2.1,336}}{4} = 0,668\,\,mol\)
\( \to\) a = 2,364 – 0,668 = 1,696 mol
Quy đổi hỗn hợp X thành (HCOO)3C3H5 (x mol), CH2 (y mol) và H2 (-0,032 mol)
\( \to\) mX = 176x + 14y – 0,032.2 = 13,728 (1)
\({n_{C{O_2}}} + {n_{{H_2}O}} = (6{\rm{x}} + y) + (4{\rm{x}} + y - 0,032) = 1,696\)(2)
Từ (1) và (2) \( \to\) x = 0,016 mol; y = 0,784 mol
Ta có: nNaOH = 3x = 0,048 mol; \({n_{{C_3}{H_5}{{(OH)}_3}}} = x = 0,016\,\,mol\)
Áp dụng bảo toàn khối lượng cho phản ứng: mX + mNaOH = mmuối + mglixerol
\( \to\) mmuối = 13,728 + 0,048.40 – 92.0,016 = 14,176 gam
Chọn C.
Câu 20 (VD):
Phương pháp:
- Vì sau phản ứng còn dư chất rắn nên muối thu được là muối sắt (II)
- Bảo toàn electron tìm số mol Fe phản ứng
- Tính khối lượng Fe phản ứng
- Tìm m
Cách giải:
\({n_{NO}} = \dfrac{{2,24}}{{22,4}} = 0,1\,\,mol\)
Vì sau phản ứng còn dư 2,4 gam chất rắn nên muối thu được là muối sắt (II)
Áp dụng bảo toàn electron: 2nFe pu = 3nNO
\( \to\) nFe pu = 0,15 mol \( \to\) mFe pu = 0,15.56 = 8,4 gam
\( \to\) m = 8,4 + 2,4 = 10,8 gam
Chọn D.
Câu 21 (VD):
Phương pháp:
- Từ phương trình (2) và (3) tìm X3
- Từ phản ứng (1) tìm X
- Suy ra X2
- Suy ra CTCT của X6
- Kết luận phân tử khối của X6
Cách giải:
Từ phản ứng (2) và (3) \( \to\) X3 là C4H8(COOH)2
Từ phản ứng (1) \( \to\) X là C2H5OOC-C4H8-COOH
\( \to\) X2 là C2H5OH
\( \to\) X6 là C4H8(COOC2H5)2
Chọn D.
Câu 22 (TH):
Phương pháp:
- Chất tạo phức màu tím với Cu(OH)2 là tripeptit trở lên
- Chất tác dụng với AgNO3 trong NH3 tạo kết tủa Ag phải có nhóm CHO
- Chất tác dụng với nước brom tạo kết tủa trắng là phenol hoặc anilin
Cách giải:
Chất X tác dụng với Cu(OH)2 tạo hợp chất màu tím \( \to\) X là Gly – Ala – Gly
Chất Y tác dụng với dung dịch AgNO3 trong NH3 tạo kết tủa Ag \( \to\) Y là etyl fomat
Chất Z tác dụng với nước brom tạo kết tủa trắng \( \to\) Z là anilin
Chọn A.
Câu 23 (VD):
Phương pháp:
- Quy đổi hỗn hợp thành C2H5NO, CH2 và CO2
- Lập phương trình biểu diễn số mol bazơ (1)
- Lập phương trình tổng khối lượng CO2 và H2O (2)
- Từ (1) và (2) tìm được số mol các chất
- Tính số mol O2
- Tính V
Cách giải:
Quy đổi X thành C2H5NO (0,2 mol), CH2 (a mol) và CO2 (b mol)
\({n_{NaOH}} = 0,1\,\,mol;{n_{K{\rm{O}}H}} = 0,14\,\,mol\)
\( \to {n_{O{H^ - }}} = 0,1 + 0,14 = 0,24\,mol\)
\( \to\) 0,2 + b = 0,24 (1)
\({m_{C{O_2}}} + {m_{{H_2}O}} = 56,88\,\,gam\)
\( \to 44(0,2.2 + a + b) + 18(0,2.2,5 + a) = 56,88\)(2)
Từ (1) và (2) \( \to\) a = 0,46; b = 0,04
\( \to {n_{{O_2}}} = 2,25.0,2 + 1,5{\rm{a}} = 1,14\)
\( \to\) V = 1,14.22,4 = 25,536 lít
Chọn D.
Câu 24 (VD):
Phương pháp:
- Tính thể tích C2H5OH
- Tính khối lượng C2H5OH
- Tính số mol C2H5OH
- Suy ra số mol tinh bột
- Tính khối lượng tinh bột, suy ra khối lượng gạo.
Cách giải:
\({V_{{C_2}{H_5}OH}} = 10.46\% = 4,6\)lít
\( \to {m_{{C_2}{H_5}OH}} = 4,6.0,8 = 3,68(kg)\)
\( \to {n_{{C_2}{H_5}OH}} = \dfrac{{3,68}}{{46}} = 0,08\left( {kmol} \right)\)
\({({C_6}{H_{10}}{O_5})_n} \to {C_6}{H_{12}}{O_6} \to 2{C_2}{H_5}OH\)
0,04 0,08
\({m_{{C_6}{H_{10}}{O_5}}} = \dfrac{{0,04.162}}{{80\% }} = 8,1kg\)
\( \to\) mgạo = \(\dfrac{{8,1}}{{75\% }} = 10,8kg\)
Chọn C.
Câu 25 (VD):
Phương pháp:
Dựa vào lý thuyết về tính chất và điều chế các chất hữu cơ.
Cách giải:
(a) Đúng, đá bọt giúp chất lỏng sôi êm dịu hơn
(b) Đúng, SO2 là sản phẩm phụ, cần được loại bỏ
(c) Đúng
(d) Sai, X là C2H4
(e) Đúng
\({C_2}{H_4} + KMn{O_4} + {H_2}O \to {C_2}{H_4}{(OH)_2} + K{\rm{O}}H + Mn{O_2}\)
(g) Đúng, việc này giúp mình nóng đều, tránh bị vỡ
Chọn C.
Câu 26 (VD):
Phương pháp:
Xem lại lý thuyết tổng hợp về hóa học hữu cơ.
Cách giải:
(a) Đúng
(b) Đúng
(c) Sai
(d) Đúng
(e) Đúng
(f) Đúng
Chọn B.
Câu 27 (VD):
Phương pháp:
Viết các CTCT thỏa mãn yêu cầu đề bài.
Cách giải:
C8H15O4N + NaOH \( \to\) NaOOC-CH2-CH2CH(NH2)COONa + ancol
Các cấu tạo của C8H15O4N
CH3CH2CH2OOCCH2CH2CH(NH2)COOH
(CH3)2CHOOCCH2CH2CH(NH2)COOH
HOOCCH2CH2CH(NH2)COOCH2CH2CH3
HOOCCH2CH2CH(NH2)COOCH(CH3)2
CH3OOCCH2CH2CH(NH2)COOC2H5
C2H5OOCCH2CH2CH(NH2)COOCH3
Chọn B.
Câu 28 (VD):
Phương pháp:
- Vì Z có khối lượng lớn hơn X nên Zn phản ứng hết, Fe phản ứng một phần
- Gọi số mol Zn và Fe phản ứng lần lượt là a và b
- Biểu diễn khối lượng hỗn hợp X (1)
- Biểu diễn khối lượng hỗn hợp Z (2)
- Giải ra a, b
- Tính %mFe
Cách giải:
Vì mZ > mX nên Zn phản ứng hết, Fe phản ứng một phần
Đặt a, b là số mol Zn và Fe đã phản ứng.
Ta có: mX = 65a + 56b + 0,28 = 2,7
Và mZ = 64(a + b) + 0,28 = 2,84
\( \to\) a = b = 0,02
\( \to \% {m_{F{\rm{e}}}} = \dfrac{{56b + 0,28}}{{{m_X}}}.100\% = 51,85\% \)
Chọn B.
Câu 29 (VD):
Phương pháp:
- Từ khối lượng bình tăng và khối lượng khí H2 tính được khối lượng ancol
- Tính số mol ancol theo số mol H2
- Suy ra ancol
- Đặt công thức của các este là CnH2n+1COOCH3 (a mol) và CmH2m-1COOCH3 (b mol)
- Biểu diễn số mol ancol CH3OH
- Biểu diễn khối lượng hỗn hợp
- Biểu diễn số mol H2O
- Suy ra a, b, an+bm
- Biện luận để tìm ra công thức các este
- Tính % khối lượng este không no
Cách giải:
\({m_{ancol}} - {m_{{H_2}}} = 2,48 \to {m_{ancol}} = 2,56\,\,gam\)
Mà nancol = 0,08 mol
\( \to\) ancol là CH3OH
Đặt công thức este là CnH2n+1COOCH3 (a mol) và CmH2m-1COOCH3 (b mol)
\( \to {n_{C{H_3}OH}} = a + b = 0,08\)
\({m_{hh}} = a(14n + 60) + b(14m + 58) = 5,88\)
\({n_{{H_2}O}} = a(n + 2) + b(m + 1) = 0,22\)
\( \to\) a = 0,06 và b = 0,02 và an + bm = 0,08
\( \to\) 3n + m = 4
Vì axit không no có đồng phân hình học nên gốc ít nhất có 3C. Vậy m = 3 và n = 1/3
\( \to \% {m_{C{H_3}CH = CHC{\rm{OOC}}{{\rm{H}}_3}}} = \dfrac{{0,02.100}}{{5,88}}.100\% = 34,01\% \)
Chọn D.
Câu 30 (VD):
Phương pháp:
- Từ tỷ khối và thể tích tìm được số mol mỗi amin
- Biện luận công thức cấu tạo của 2 muối trong hỗn hợp ban đầu
- Lập phương trình tính số mol của mỗi amin
- Giải ra số mol các muối trong hỗn hợp ban đầu
- Kết luận và tính khối lượng các muối tạo thành
Cách giải:
\({M_E} = 33,8 \to \) E gồm CH5N (0,08 mol) và C2H7N (0,02 mol)
C4H14O3N2 là CH3NH3CO3NH3C2H5 (x mol)
Do số mol của CH5N lớn hơn số mol C2H7N nên C5H14O4N2 là CH2(COONH3CH3)2 (y mol)
\({n_{C{H_5}N}} = x + 2y = 0,08\)
\({n_{{C_2}{H_7}N}} = x = 0,02\)
\( \to\) y = 0,03
Muối Z là CH2(COONa)2 (0,03 mol)
\( \to\) mZ = 4,44 gam
Chọn D.
Search google: "từ khóa + timdapan.com" Ví dụ: "Giải đề thi học kì 1 hoá lớp 12 năm 2019 - 2020 sở giáo dục và đào tạo Đà Nẵng timdapan.com"