Bài 46.12* trang 75 SBT hóa học 11
Giải bài 46.12* trang 75 sách bài tập hóa học 11. Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau...
Đề bài
Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( \({M_Y} > {M_X}\) ). Chất Z là đồng phân của chất Y.
Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện.
Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít \({O_2}\) (đktc). Sản phẩm cháy chỉ có \(C{O_2}\) và \({H_2}O\) với số mol bằng nhau.
Nếu cho 48g M tác dụng với Na(lấy dư), thu được 1,68 lít \({H_2}\)(đktc).
Hãy xác địng công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải - Xem chi tiết
+) Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên CTPT giống chất Y.
+) Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z
+) Viết PTHH:
\({C_x}{H_y}{O_z} + (x + \frac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
+) Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn x, y, z, a, b.
+) Biện luận và giải hpt => CTPT của X, Y, Z.
+) Tính phần trăm về khối lượng của từng chất trong hỗn hợp M.
Lời giải chi tiết
Số mol 3 chất trong 3,20 g hỗn hợp M : \(\dfrac{{1,68}}{{28}}\) = 0,06 (mol).
Số mol 3 chất trong 16 g M : \(\dfrac{{0,06.16}}{{3,2}}\) = 0,3 (mol)
Khi đốt hỗn hợp M ta chỉ thu được CO2 và H2O.
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
\(\left\{ \begin{array}{l}
a + b = 0,3(1)\\
(12{\rm{x}} + y + 16{\rm{z}})a + (12{\rm{x}} + y + 16{\rm{z}} + 14)b = 16(2)
\end{array} \right.\)
Khi đốt 16 g M thì tổng khối lượng CO2 và H2O thu được bằng tổng khối lượng của M và O2 và bằng :
\(16 + \dfrac{{23,52}}{{22,4}}.32 = 49,6(g)\)
Mặt khác, số mol CO2 = số mol H2O = n :
44n + 18n = 49,6 \( \Rightarrow \) n = 0,8
\({C_x}{H_y}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
a mol xa mol \(\dfrac{y}{2}\)a mol
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
b mol (x + 1)b mol \(\dfrac{{y + 2}}{2}\)b mol
Số mol CO2 là : xa + (x + 1)b = 0,8 (mol) (3)
Số mol H2O là : \(\dfrac{{y{\rm{a}} + (y + 2)b}}{2}\) = 0,8 (mol)
do đó : ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 - 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 - 0,3x < 0,3 \( \Rightarrow \) 1,66 < x < 2,66
x nguyên \( \Rightarrow \) x = 2 \( \Rightarrow \) b = 0,8 - 0,3.2 = 0,2
\( \Rightarrow \) a = 0,3 - 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C2H4O, hai chất Y và Z có cùng CTPT là C3H6O.
Chất X chỉ có thể có CTCT là 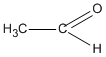 (etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên CTCT là ![]() (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH - CH2 - OH (propenol) :
2CH2 = CH - CH2 - OH + 2Na \( \to \) 2CH2 = CH - CH2 - ONa + H2\( \uparrow \)
Số mol Z trong 48 g M là : 2.số mol H2 = 2.\(\dfrac{{1,68}}{{22,4}}\) =0,15 (mol).
Số mol Z trong 16 g M là : \(\dfrac{{0,15.16}}{{48}}\) = 0,05 (mol)
Số mol Y trong 16 g M là : 0,2 - 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M :
Chất X chiếm : \(\dfrac{{0,1.44}}{{16}}\). 100% = 27,5%.
Chất Y chiếm : \(\dfrac{{0,15.58}}{{16}}\). 100% = 54,4%.
Chất Z chiếm : \(\dfrac{{0,05.58}}{{16}}\). 100% = 18,1%.
Search google: "từ khóa + timdapan.com" Ví dụ: "Bài 46.12* trang 75 SBT hóa học 11 timdapan.com"







