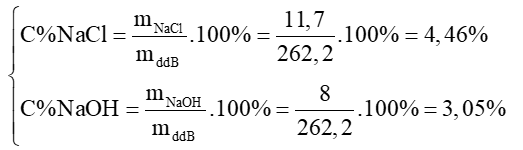Đề số 3 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
Đề số 3 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết
Đề bài
I. TRẮC NGHIỆM
Câu 1 : Dãy gồm các chất là bazơ là
A. NaOH; BaO; Ca(OH)2.
B. Ba(OH)2; MgCl2; Al(OH)3.
C. KOH, Cu(OH)2; Ca(OH)2.
D. HCl; H2SO4, HNO3.
Câu 2 : Các chất tan trong nước là
A. CuCl2; H2SO4; AgNO3.
B. S; NaNO3; KCl.
C. BaSO4; NaOH; K2SO3.
D. HBr; Fe2O3; K2CO3.
Câu 3 : Để phân biệt dung dịch Na2SO4 và Na2CO3 ta dùng thuốc thử là
A. dung dịch BaCl2.
B. dung dịch HCl.
C. dung dịch BaCO3.
D. dung dịch Na2SO4.
Câu 4 : Axit H2SO4 loãng phản ứng được với tất cả các chất trong dãy
A. Ag; CuO, KOH, Na2CO3.
B. Mg, BaCl2, Al(OH)3, CuO.
C. Al, Fe3O4, Cu(OH)2; K2SO4.
D. Na; P2O5, Mg(OH)2, CaSO3.
Câu 5 : Để nhận biết các dung dịch: Na2SO4; Ba(OH)2; NaOH cần sử dụng ít nhất số hoá chất là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6 : Dãy gồm cả oxit, axit, bazơ, muối là
A. P2O5; KMnO4; H2SO4; KCl.
B. CuO; HNO3; NaOH; CuS.
C. CuSO4; MnO2; H2S; H3PO4.
D. CuCl2; O2; H2SO4; KOH.
Câu 7 : Các chất phản ứng được với nước ở điều kiện thường là
A. P2O5; HCl; CaO; CO2.
B. NaCl; KOH; Na2O; FeO.
C. BaO; K2O; CuO; SO2.
D. CaO; Na2O; P2O5; SO3.
Câu 8 : Các chất có thể phản ứng với dung dịch axit HCl là
A. Fe2O3; Cu; Mg(OH)2; AgNO3.
B. Fe(OH)3; Na2SO4; K; MnO2.
C. CuO; CaCO3; Ba; Al(OH)3.
D. P2O5; KOH; Fe; K2CO3.
Câu 9 : Dung dịch làm quỳ tím hóa đỏ là
A. HCl.
B. K2SO4.
C. NaOH.
D. KOH.
Câu 10 : Hóa chất có thể dùng để nhận biết axit sunfuric và natri sunfat là dung dịch
A. NaCl.
B. BaCl2.
C. Na2CO3.
D. Na2SO4.
Câu 11 : Cặp chất có thể phản ứng với nhau là
A. HCl và Na2SO4.
B. NaOH và BaCl2.
C. AgCl và NaNO3.
D. H2SO4 và BaCO3.
Câu 12 : Cho những khí sau: CO2, H2, O2, SO2. Khí làm đục nước vôi trong là
A. CO2, O2.
B. CO2, H2, SO2.
C. CO2, SO2.
D. CO2, O2, H2.
Câu 13 : Để hòa tan hoàn toàn 5,1 gam oxit của một kim loại hóa trị III người ta phải dùng 43,8 g dung dịch HCl 25%. Kim loại của oxit là
A. Fe.
B. Al.
C. Cr.
D. Cu.
Câu 14 : Cho 1,84 hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít khí CO2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là
A. 1,17 g.
B. 3,17 g.
C. 2,17 g.
D. 4,17 g.
Câu 15 : Có 3 lọ không nhãn đựng một trong các dung dịch sau: BaCl2, HCl, H2SO4. Thuốc thử có thể nhận biết được cả 4 chất trên là
A. H2O.
B. khí CO2.
C. dung dịch Na2SO4.
D. quỳ tím.
II. TỰ LUẬN
Câu 16 : Nêu hiện tượng xảy ra trong các trường hợp sau:
a) Cho đinh sắt vào dung dịch đồng (II) sunfat.
b) Cho dung dịch BaCl2 vào dung dịch H2SO4 loãng.
c) Cho vài giọt dung dịch phenolphtalein vào dung dịch NaOH sau đó thêm từ từ đến dư dung dịch axit HCl.
Câu 17 : Viết phương trình thực hiện chuyển đổi hoá học sau:
\(Cu\xrightarrow{(1)}CuO\xrightarrow{(2)}CuC{{l}_{2}}\xrightarrow{(3)}Cu{{(N{{O}_{3}})}_{2}}\xrightarrow{(4)}Cu{{(OH)}_{2}}\xrightarrow{(5)}CuO\xrightarrow{(6)}Cu\)
Câu 18 : Hòa tan 25,9g hỗn hợp hai muối khan gồm NaCl và Na2SO4 vào nước thì thu được 200g dung dịch A. Cho dung dịch A vào dung dịch Ba(OH)2 20% vừa đủ thấy xuất hiện 23,3g kết tủa, lọc bỏ kết tủa thu được dung dịch B.
a) Viết các phương trình hóa học.
b) Tính khối lượng mỗi muối khan trong hỗn hợp ban đầu.
c) Tính nồng độ phần trăm các chất có trong dung dịch B.
Lời giải chi tiết
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1.C |
2.D |
3.C |
4.D |
5.D |
|
6.B |
7.B |
8.C |
9.A |
10.C |
|
11.C |
12.A |
13.C |
14.C |
15.A |
Câu 1
A sai vì BaO không phải bazơ mà là oxit bazơ.
B sai vì MgCl2 là muối không phải bazơ.
C đúng.
D sai vì cả 3 chất đều là axit.
Đáp án C
Câu 2
A đúng.
B sai vì S không tan trong nước.
C sai vì BaSO4 không tan trong nước.
D sai vì Fe2O3 không tan trong nước.
Đáp án A
Câu 3
A sai vì BaCl2 cho kết tủa trắng với cả 2 dung dịch.
B đúng do HCl tạo khí với dung dịch Na2CO3 và không phản ứng với dung dịch Na2SO4.
C sai vì BaCO3 là kết tủa không thể phản ứng với cả 2 dung dịch.
D sai vì Na2SO4 không phản ứng với cả 2 dung dịch.
Đáp án B
Câu 4
A sai vì Ag không phản ứng với H2SO4 loãng.
B đúng.
C sai vì K2SO4 không phản ứng với H2SO4 loãng.
D sai vì P2O5 không phản ứng với axit H2SO4 loãng.
Đáp án B
Câu 5
Để nhận biết Na2SO4, NaOH, Ba(OH)2 ta chỉ cần sử dụng 1 hóa chất : dung dịch phenol phtalein hoặc quỳ tím.
- Sử dụng dd phenol phtalein vào 3 mẫu thử của 3 dung dịch thì
+ dd có màu hồng là NaOH và Ba(OH)2
+ dd không màu là Na2SO4
- Sử dụng quỳ tím nhúng vào 3 mẫu thử của 3 dung dịch thì
+ quỳ tím hóa xanh là NaOH và Ba(OH)2
+ quỳ tím không đổi màu là Na2SO4
- Cho dd Na2SO4 vừa nhận biết được ở trên vào 2 dd còn lại
+ dd xuất hiện kết tủa trắng là Ba(OH)2
+ dd không có hiện tượng là NaOH
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
Đáp án A
Câu 6
A sai vì không có bazơ.
B đúng.
C sai vì không có bazơ.
D sai vì không có oxit.
Đáp án B
Câu 7
A sai vì HCl tan trong nước chứ không phản ứng với nước.
B sai vì chỉ có Na2O phản ứng được với nước ở điều kiện thường.
C sai vì CuO không phản ứng với nước.
D đúng.
Đáp án D
Câu 8
A sai vì Cu không phản ứng với HCl.
B sai vì Na2SO4 không phản ứng với HCl.
C đúng.
D sai vì P2O5 không phản ứng với HCl.
Đáp án C
Câu 9
A đúng vì HCl là axit làm quỳ tím hóa đỏ.
B sai vì K2SO4 là muối không làm đổi màu quỳ tím.
C sai vì NaOH là bazơ làm quỳ tím hóa xanh.
D sai vì KOH llà bazơ làm quỳ tím hóa xanh.
Đáp án A
Câu 10
A sai vì NaCl không phản ứng với cả 2 chất nên không có hiện tượng.
B sai vì BaCl2 tạo kết tủa trắng với cả 2 chất nên không nhận biết được.
C đúng vì Na2CO3 chỉ phản ứng với H2SO4 tạo khí, chất còn lại không phản ứng.
Na2CO3 + 2H2SO4 → Na2SO4 + CO2↑ + H2O
D sai vì Na2SO4 không phản ứng với cả 2 chất nên không có hiện tượng.
Đáp án C
Câu 11
A sai 2 chất này không phản ứng với nhau.
B sai 2 chất này không phản ứng với nhau.
C sai 2 chất này không phản ứng với nhau.
D đúng vì BaCO3 + H2SO4 → BaSO4 + H2O + CO2
Đán án D
Câu 12
O2 và H2 không phản ứng với nước vôi trong.
CO2 và SO2 làm đục nước vôi trong do phản ứng
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH) → CaSO3↓ + H2O
Đáp án C
Câu 13
Phương pháp:
Gọi công thức của oxit hóa trị III là M2O3 ( với M là kim loại)
Công thức tính nồng độ phần trăm của dung dịch HCl
\(C%=\frac{{{m}_{HCl}}}{m{{}_{ddHCl}}}.100%\)
PTHH
M2O3 + 6HCl → 2MCl3 + 3H2O
Tính số mol M2O3 theo số mol HCl => M
Hướng dẫn giải:
Công thức hóa học của oxit hóa trị III là M2O3 ( với M là kim loại)
mHCl = 10,95 g. ⟹ nHCl = 0,3 mol.
PTHH
M2O3 + 6HCl → 2MCl3 + 3H2O
0,05 ← 0,3 (mol)
⟹ 0,05.(2M + 48) = 5,1
⟹ M = 27 (Al).
Đáp án B
Câu 14
Phương pháp:
PTHH
ACO3 + 2HCl → ACl2 + H2O + CO2
BCO3 + 2HCl → BCl2 + H2O + CO2
Theo PTHH ⟹
Áp dụng định luật bảo toàn khối lượng
Hướng dẫn giải:
PTHH
ACO3 + 2HCl → ACl2 + H2O + CO2
BCO3 + 2HCl → BCl2 + H2O + CO2
Theo PTHH ⟹
⟹ nHCl = 2.0,03 = 0,06 mol.
Áp dụng định luật bảo toàn khối lượng
\({{m}_{hh}}\ +{{m}_{HCl}}\ ={{m}_{muoi}}\ +{{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}\)
⟹ 1,84 + 0,06.36,5 = mmuối + 0,03.44 + 0,03.18
⟹ mmuối = 2,17 gam.
Đáp án C
Câu 15
Thuốc thử để nhận biết 3 dd này là quỳ tím
Cho quỳ tím vào các mẫu thử ta thấy
- quỳ tím hóa đỏ là HCl và H2SO4 (nhóm I).
- quỳ tím không đổi màu là BaCl2.
Lần lượt cho BaCl2 vào từng ống nghiệm chứa từng dung dịch của nhóm I.
- Nếu xuất hiện kết tủa trắng là H2SO4.
- Còn lại HCl không hiện tượng.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Đáp án D
Câu 16
Phương pháp:
Viết PTHH của từng phản ứng và đưa ra hiện tượng.
Hiện tượng quan sát được là những gì mắt thường nhìn thấy được như: sự thay đổi trạng thái, màu sắc của dung dịch, có xuất hiện khí hay không, có xuất hiện kết tủa hay không, kết tủa có màu gì, khí có mùi hay không…
Hướng dẫn giải:
a) Đinh sắt bị hòa tan một phần, kim loại đồng màu đỏ bám ngoài đinh sắt, dung dịch xanh nhạt màu dần.
PTHH: Fe + CuSO4 → FeSO4 + Cu↓
b) Xuất hiện kết tủa trắng.
PTHH: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
c) Dung dịch chuyển màu hồng sau đó dần trở lại không màu.
PTHH: HCl + NaOH → NaCl + H2O
Câu 17
(1) 2Cu + O2 \(\xrightarrow{{{t}^{0}}}\) 2CuO
(2) CuO + 2HCl → CuCl2 + H2O
(3) CuCl2 + 2AgNO3 → 2AgCl + Cu(NO3)2
(4) Cu(NO3)2 + 2NaOH → Cu(OH)2+ 2NaNO3
(5) Cu(OH)2 \(\xrightarrow{{{t}^{0}}}\) CuO + H2O
(6) CuO + H2 \(\xrightarrow{{{t}^{0}}}\) Cu + H2O
Câu 18
Phương pháp:
a) Viết PTHH.
b) Tính toán theo phương trình hóa học.
c) Tính khối lượng Ba(OH)2 từ đó tính được khối lượng dung dịch Ba(OH)2
Tính khối lượng dd B theo công thức:
⟹ Tính nồng độ phần trăm các chất có trong dung dịch B.
Hướng dẫn giải:
a) Khi cho hh muối khan gồm NaCl và Na2SO4 vào nước ta thu được dd A chứa chất tan là NaCl và Na2SO4.
Cho dd A tác dụng với dd Ba(OH)2 chỉ có dd Na2SO4 phản ứng còn dd NaCl không phản ứng.
PTHH: Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
b) Kết tủa thu được là BaSO4 có khối lượng 23,3 gam.
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
0,1 0,1 0,1 0,2 (mol)
⟹ = 0,1.142 = 14,2 (g).
⟹ mNaCl = 25,9 – 14,2 = 11,7 (g).
c) Trong dung dịch B gồm NaCl và NaOH
* mNaOH = 0,2.40 = 8 (g).
* = 0,1.171 = 17,1 (g).
* Khối lượng dd Ba(OH)2 20% cần dùng là:
\({{m}_{ddBa{{(OH)}_{2}}}}=\frac{{{m}_{Ba{{(OH)}_{2}}}}}{C%}.100%=\frac{17,1}{20%}.100%=85,5(g)\)
Khối lượng dd B thu được là:
mddB = 200 + 85,5 – 23,3 = 262,2 (g)
dd B chứa các chất tan là: NaCl: 11,7 gam và NaOH: 8 gam.
Nồng độ phần trăm các chất tan có trong dd B là
Search google: "từ khóa + timdapan.com" Ví dụ: "Đề số 3 - Đề kiểm tra giữa học kì I - Hóa học 9 có đáp án và lời giải chi tiết timdapan.com"