Đề kiểm tra học kì 1 môn Hóa học lớp 10
Đề kiểm tra học kì 1 môn Hóa học lớp 10 trường THPT Phan Đăng Lưu có đáp án là đề thi học kì I lớp 10 hay dành cho các bạn học sinh luyện đề nhằm củng cố kiến thức, ôn thi học kì I hiệu quả. Hi vọng tài liệu này sẽ giúp các bạn đạt kết quả tốt trong các bài thi, bài kiểm tra. Mời các bạn tham khảo.
- Tóm tắt lý thuyết Hóa học 10 - Chương 2: Bảng tuần hoàn các nguyên tố hóa học - Định luật tuần hoàn
- Đề kiểm tra 1 tiết môn Hóa học lớp 10 chương 1 học kì 1
- Tóm tắt lý thuyết Hóa học 10 - Chương 3: Liên kết hóa học
ĐỀ KIỂM TRA HỌC KỲ 1
MÔN: HÓA HỌC 10
Thời gian làm bài: 45 phút
Câu 1: (2 điểm)
- Vì sao nguyên tử của các nguyên tố (trừ khí hiếm) có xu hướng liên kết với nhau tạo thành phân tử hay tinh thể? (1 điểm)
- Nguyên tử của nguyên tố X có điện tích hạt nhân là 17+. Hãy xác định vị trí của X trong bảng tuần hoàn. (1 điểm)
Câu 2: (2 điểm)
- Thế nào là phản ứng oxi hóa – khử? (1 điểm)
- Cân bằng phản ứng sau đây theo phương pháp thăng bằng electron, xác định chất oxi hóa, chất khử: (1 điểm)
HCl + MnO2 → MnCl2 + Cl2 + H2O
Câu 3: (2 điểm)
- Hãy so sánh tính kim loại của magie (Mg), Z = 12, với nguyên tố đứng trước: natri (Na), Z = 11, và nguyên tố đứng sau: nhôm (Al), Z = 13.
- Viết công thức cấu tạo của NaCl, CO2. Cho biết tên liên kết.
Câu 4: (1 điểm)
Trong một nguyên tử X, tổng số các hạt proton, notron và electron là 40. Biết rằng số notron bằng số proton cộng thêm một. Viết ký hiệu của X.
Cho: Na (Z = 11); Mg (Z = 12), Al (Z = 13), Si (Z = 14)
Câu 5: (3 điểm)
Cho 19,5 g kim loại R thuộc nhóm IA (kim loại kiềm) vào nước thu được dung dịch A và 5,6 lit khí hidro ở điều kiện chuẩn.
a) Xác định kim loại R?
b) Trung hòa toàn bộ lượng dung dịch A bằng 500 ml dung dịch axit clohidric. Tính nồng độ dung dịch axit cần dùng?
Cho K = 39; Na = 23; Li = 7; Cl = 35,5; O = 16; H = 1
...................HẾT................
Đáp án đề kiểm tra học kì 1 môn Hóa học lớp 10
Câu 1: (2 điểm)
1) Ngoại trừ khí hiếm, cấu hình electron lớp ngoài cùng của các nguyên tử khác chưa đạt cơ cấu bền. Do đó, chúng có xu hướng liên kết với nhau tạo thành tinh thể hay phân tử để đạt tới cấu hình electron bền vững của khí hiếm gần nó với 8e (hoặc 2e đ/v He) ở lớp ngoài cùng.
Chú ý: Trong câu này nếu học sinh phát biểu được các ý sau:
* Cấu hình các nguyên tử chưa đạt cơ cấu bền ở lớp ngoài cùng.
* Khuynh hướng đạt cơ cấu bền của khí hiếm gần nhất thì cho trọn số điểm, nếu chỉ nói được 1 trong 2 ý chỉ cho 0,5 điểm.
2) X có điện tích hạt nhân 17+ X có Z = 17
Cấu hình electron của X: 1s2 2s2 2p6 3s2 3p5
Vị trí:
- X thuộc ô 17
- X thuộc chu kỳ 3
- X thuộc nhóm VIIA
Câu 2: (2 điểm)
1) Phản úng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất phản ứng
Chú ý: Học sinh có thể phát biểu: Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Vẫn cho trọn số điểm.
Nếu học sinh phát biểu: phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tử thì chỉ cho ½ điểm số.
2) Cân bằng phản ứng:
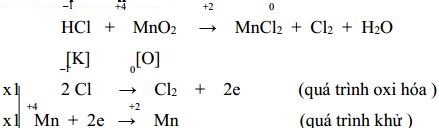
Chú ý: Ghi sai số oxi hóa của phần nào không cho điểm phần đó, các phần khác đúng vẫn cho điểm.
Không ghi tên các quá trình, không trừ điểm.
Học sinh không ghi lại phương trình hóa học cuối cùng mà điền hệ số vào sơ đồ đầu tiên, nếu đúng vẫn cho trọn điểm
Câu 3: (2 điểm)
1) Học sinh nêu được ý: Mg đứng sau Na nên Mg có tính kim loại yếu hơn Na, và đứng trước Al nên có tính kim loại mạnh hơn Al
Hay ghi so sánh: Na > Mg > Al
Hoặc: Al < Mg < Na
Đều chấm đúng
2) Viết công thức cấu tạo: NaCl, CO2, cho biết tên liên kết
NaCl: Na – Cl liên kết ion
CO2: O = C = O liên kết cộng hóa trị phân cực
Chú ý: Nếu học sinh chỉ ghi liên kết cộng hóa trị, chỉ cho 0,25 điểm
Câu 4: (1 điểm)
Đặt số p = số e => 2Z + N = 40 (1)
Số n = N => N - Z = 1 (2)
Giải (1) và (2) ta được
→ Z = 13
N = 14
A = 13 + 14 = 27 → X là nhôm
Ký hiệu nguyên tử của nhôm: 2713Al
Học sinh có thể giải cách khác, nếu đúng vẫn cho trọn điểm
Nếu học sinh chỉ ghi thì không cho điểm ký hiệu nguyên tử
Câu 5: (3 điểm)
1) Xác định R: Phương trình hóa học:
2R + 2H2O → 2ROH + H2
Mol: 0,5 ← 0,5 ← 0,25
Số mol hidro = 5,6 : 22,4 = 0,25 mol
Khối lượng mol nguyên tử của R = 19,5 : 0,5 = 39 g/mol
Vậy R là kali (K)
2) Tính nổng độ mol của dung dịch HCl:
Dung dịch A là dung dịch KOH. Phương trình hóa học:
KOH + HCl → KCl + H2O
0,5 → 0,5 (mol)
Nồng độ mol của dung dịch HCl:
[HCl] = 0,5 : 0,5 = 1 mol/l
Chú ý: Nếu học sinh không viết phương trình hóa hoc R phản ứng với nước thì không cho điểm bài toán.
Nếu viết phương trình hóa học mà cân bằng sai thì cho phản ứng 0,25 đ và không chấm phần dưới. Nếu không cân bằng mà xác định đúng số mol của R thì cho ½ số điểm của câu đó.
Nếu không ghi đơn vị chỉ cho ½ số điểm của câu đó.
Nếu không KOH mà ghi ROH vẫn cho điểm.
.........................................
Trên đây TimDapAnđã gửi tới bạn đọc Đề kiểm tra học kì 1 môn Hóa học lớp 10 trường THPT Phan Đăng Lưu, đề thi gồm 5 câu hỏi tự luận, mỗi câu được chia nhỏ các ý, để giúp các bạn học sinh không bị mât điểm. Đề thi xây dựng trên các cấp độ khác nhau, để đánh giá đúng năng lực của các bạn học sinh.
Để có kết quả học tập tốt và hiệu quả hơn, TimDapAnxin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà TimDapAntổng hợp biên soạn và đăng tải.









